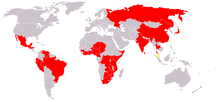
بیماری' یا مرض (Disease) به ناهنجاری در بدن یا روان میگویند که به علت ناراحتی، اختلال عملکرد یا تنش دربیمار یا سایر افراد مرتبط با او ایجاد میگردد. البته باید میان بیماری و سایر حالتهای پزشکی مانند خستگی، ضعف، کسالت و اندوه تفاوت گذاشت. عامل ایجاد بیماری میتواند بیرونی( مانند باکتری، انگل، تغذیه ناکافی و...) یا درونی ( مانند پرکاری تیروئید، دیابت و ...) باشد. همچنین بیماری میتواند مادرزادی (مانند سندرم ترنر یا لب شکری) یا ژنتیکی مانند آلبینیسم باشد. بیماری تند(حاد) یا کهنه(مزمن)، واگیر دار یا ناواگیر نیز میتواند باشد.
هر بیماری با شماری علائم و نشانههای ویژه شناخته و آشکار میشود . شناخت و درمان بیماری بر عهده پزشک است.
طبقه بندی
بیماری ها را به روشهای مختلف میتوان طبقه بندی کرد:
1. عامل ایجادکننده بیماری مانند بیماریهای عفونی ، بیماریهای ژنتیکی ، بیماریهای شغلی ، بیماریهای روانی .
سرطان
سَرَطان یا سرتان یا چَنگار[۱] تقسیم نامتقارن سلولهای بدن. سلولهای سرطانی از سازوکارهای عادی تقسیم و رشد سلولها جدا میافتند. علت دقیق این پدیده نامشخص است ولی احتمال دارد عوامل ژنتیکی یا مواردی که موجب اختلال در فعالیت سلولها میشوند در هسته سلول اشکال وارد کنند، مانند مواد رادیو اکتیو، مواد شیمیایی و سمی یا تابش بیش از حد اشعههایی مانند نور آفتاب.[۲] در یک جاندار سالم، همیشه بین میزان تقسیم سلول، مرگ طبیعی سلولی و تمایز، یک تعادل وجود دارد.
سرطان شامل همه انواع تومورهای بدخیم میشود[۳] که در پزشکی آنها را بیشتر با نام نئوپلاسم میشناسند. وقتی که یکی از سلول های بدن توسط عوامل مختلف رشدی غیر طبیعی می کند و باعث رشد غیر عادی سلول های دیگر می شود و در نهایت منجربه تولید تومر میشود که آن قسمت را از کار می اندازد وبه قسمت های دیگر نیز سرایت می کند. احتمال بروز سرطان در سنین مختلف وجود دارد ولی احتمال بروز سرطان با افزایش سن زیادتر میشود[۴] سرطان باعث ۱۳٪ مرگها است[۵] بر طبق گزارش انجمن بهداشت آمریکا ۷٫۶ میلیون نفر بر اثر سرطان و در سال ۲۰۰۷ مردهاند[۶] سرطان تنها ویژه انسان نیست و همه جانوران و گیاهان پرسلولی نیز ممکن است به سرطان دچار شوند. سرطان بیماری پیش رونده است.
تفاوتهای بارزی در میزان وقوع و مرگ و میر ناشی از انواع سرطان در سرتاسر دنیا وجود دارد. برای مثال میزان مرگ ناشی از سرطان معده در ژاپن ۷ تا ۸ برابر آمریکا است درمقابل میزان مرگ و میر ناشی از سرطان ریه در آمریکا کمی بیش از ۲ برابر ژاپن است. مرگ و میر ناشی از سرطان پوست که بیشتر به علت ملانوم بدخیم میباشد در نیوزلند ۶ برابر شایع تر ایسلند است که مهمترین علت آن تفاوت در معرض نور خورشید قرار گرفتن (یا نقص لایه ازن) میباشد.
اکثر سرطانهای تخمدان از یک سلول منفرد طی تجمع اختلالات ژنتیکی و اپی ژنتیکی ایجاد میگردد. این اختلالات باعث عدم کنترل بر تقسیمات سلولی، ناپایداری ژنتیکی، مقاومت به آپوپتوز، نامیرایی، قابلیت تهاجم یافتن، متاستاز و رگ زائی، مهار آپوپتوز و در نهایت باعث نامیرایی سلولهای سرطانی میشود.[نیازمند منبع]
سرطان پستان و پروستات هنوز به ترتیب از شایعترین انواع سرطان در زنان و مردان است و موارد سرطان ریه در زنان در حال افزایش است. همچنین موارد تومورهای مری که در اثر اسیدهای واکنشی در اثر چاقی ایجاد میشود اکنون بیشتر در مراکز درمانی دیده میشود. سرطان در نواحی سر و گردن که توسط نوعی ویروس ایجاد میشود در حال افزایش است که گفته میشود که سکس دهانی عامل اصلی انتقال این نوع ویروس است. [۷]
بر اساس بررسیهای تازه، افزایش نرخ امید به زندگی به این معنی است که افراد بیشتر عمر می کنند و تعداد بیشتری از آنها تحت تاثیر این بیماری قرار خواهند گرفت. اما همین گزارشها میگویند که روش زندگی بهتر مانند کاهش وزن و سیگار نکشیدن، میتواند تاثیر مهمی در عدم ابتلا به این بیماری داشته باشد. اما به گفته پروفسور پیتر سیسیانی، از دانشگاه کویین مری، افزایش موارد سرطان "اجتناپ ناپذیر نیست." او میافزاید: "کارهای زیادی است که میتوانیم برای جلوگیری از ابتلا به سرطان انجام دهیم." اشاره او به عواملی در زندگی روزمره مانند چاقی، گوشت قرمز و یا استفاده از دخانیات است که خطر ایجاد و رشد تومور را افزایش میدهد. همچنین دکتر سیسیانی گفت که دنبال کردن یک روش زندگی سالم میتواند خطر ابتلا به سرطان را در طول زندگی یک فرد از ۵۰ درصد به ۳۰ درصد کاهش دهد. [۸]
سازمان بهداشت جهانی اعلام کرد که بیماری چاقی بویژه در کشورهای توسعه یافته یکی از عوامل اصلی ابتلا به سرطان به شمار می رود. همچنین سازمان ملل از افزایش سرطان های ناشی از چاقی در کشورهای توسعه یافته خبر داد. تنها در سال ۲۰۱۲ بیماری چاقی در کشورهای توسعه یافته باعث ابتلای ۴۸۱ هزار نفر از مردم این کشور ها به بیماری سرطان بویژه در میان زنان شده است. ذکر اینکه رقم افرادی که در اثر بیماری چاقی بیش از حد به سرطان مبتلا شده اند ۳٬۶ درصد از مجموع بیماران سرطانی جهان در سال ۲۰۱۲ را تشکیل میدهد تصریح کرده است که از طریق مقابله با بیماری چاقی می توان دست کم ۲۵ درصد از آمار ابتلا به سرطان در این جوامع را کاهش داد. در این گزارش اشاره شده است که کشورهای منطقه آمریکای شمالی در سال ۲۰۱۲ با ۱۱۱ هزارنفر بیمار یعنی معادل ۲۳ درصد از مجموع مبتلایان به سرطان های ناشی از چاقی ، در صدر جدول این بیماران و کشورهای اروپای شرقی با نزدیک به ۶۵ هزار نفر در مقام دوم قرار دارند. [۹]
- دخانیات: مصرف دخانیات در ایجاد سرطان در مجاری تنفسی نقش اساسی دارد. ۹۰٪[۱۰] ابتلا به سرطان ریه به دلیل کشیدن سیگار رخ میدهد. سیگار کشیدن مهمترین عامل محیطی منفرد در وقوع مرگ زودرس در آمریگا میباشد.[۱۱]
- مواد غذایی: مصرف الکل در ابتلا به سرطانهای دهان (به غیر از لب)، حنجره، مری و به دلیل ایجاد سیروز الکلی احتمال بروز سرطان کبد را بالا میبرد. مصرف قند در طول دوره درمان سرطان ممنوع است زیرا سلولهای سرطانی با مصرف قند میتواند بهتر بافتهای دیگر بدن را آلوده کنند. معنی این حرف این است که سلول سرطانی با مصرف قند قوی تر می شودو باسرعت بالاتری تکثیر میشوند. توضیح ساده آن این است که سلول سرطانی دارای ۹۴گیرنده قند است ولی سلول بدن دارای ۴ گیرنده است وهر مولکول قندی را که ببیند جذب میکند و بزرگتر میشود.
- پرتوها: برخی از پرتوها همچون پرتوهای فرابنفش خورشید موجب سرطانهایی چون سرطان پوست میشوند.
- عفونتهای باکتریایی و یا ویروسی: برخی سرطانها همچون سرطان گردن رحم به علت عفونتهای ویروسی (ویروس پاپیلومای انسانی) بروز میکنند..[۱۲]
محتویات
عوامل ژنتیکی
وجود سابقه سرطان بین اعضای نزدیک خانواده احتمال دچار شدن به سرطان را افزایش میدهد. وجود جهش در برخی ژنها (که به آنها آنکوژن و ژنهای سرکوبگر تومور میگویند، باعث بروز سرطان میشود.
ژندرمانی
در ژندرمانی سرطان از اولیگونوکلئوتیدها استفاده میشود. نمونهای از این روش برای جلوگیری از ساخته شدن پروتئین پیجیپی برای خارج نشدن داروهای ضدّسرطان از سلولها میباشد.
عوامل ایمنولوژیک (ایمنی)
نارسایی مکانیسم ایمنی طبیعی بدن عاملی مستعد کننده در ایجاد سرطان ریه شناخته شدهاست.
سن
افزایش سن احتمال دچار شدن به برخی سرطانها را به شدت افزایش میدهد. اغلب سرطانها در سنین حدود ۵۵ سال یا بیشتر از آن رخ میدهند. سرطان یکی از علتهای اصلی مرگ در میان زنان ۴۰ تا ۷۹ سال و مردان ۶۰ تا ۷۶ سال است. سرطان کودکان کمتر از ۱۵ سال را نیز دچار میکند. سرطان علت بیش از ۱۰ درصد موارد مرگ و میر در این گروه سنی در آمریکا میباشد. لوسمی حاد (نوعی سرطان خون) و سرطانهای دستگاه عصبی مرکزی حدود ۶۰ درصد مرگ و میرها را در این سن باعث میشوند.[۱۳][۱۴]
انواع سرطان
سرطانهای بدخیم به دو دسته سارکومها و کارسینومها تقسیم میشوند
گسترش سرطان
سرطان به سه طریق به شرح زیر در بدن گسترش مییابد:
از طریق بافت: سرطان به بافت نرمال مجاور حمله میکند.
از طریق دستگاه لنفاوی: سرطان به دستگاه لنفاوی حمله میکند و در عروق لنفاوی حرکت مینماید و به دیگر نقاط بدن میرسد.
از طریق خون: سرطان به سیاهرگها و مویرگها حمله میکند و همراه خون به دیگر نقاط بدن میرسد.
هنگامیکه سلولهای سرطانی از تومور اولیه (اصلی) جدا میشوند و همراه لنف یا خون به دیگر نقاط بدن میرسند، ممکن است توموری دیگر (ثانویه) تشکیل شود. این فرایند را متاستاز مینامند. تومور ثانویه (متاستازی) از همان نوع تومور اولیه است. بهعنوان مثال، اگر سرطان پستان به استخوانها گسترش یابد، سلولهای سرطانی در استخوان در واقع سلولهای سرطان پستان هستند، و بیمای سرطان متاستازی پستان است و سرطان استخوان نمیباشد.
پیشگیری
برخی از روشهای کلی مانند عدم استعمال دخانیات، مصرف غذای سالم، پرهیز از عوامل تراتوژن (برخی مواد شیمیایی صنعتی مانند آزبست، اشعه یونیزان مانند کار در رادیولوژی، نور آفتاب و...)، ورزش[۱۵] و خودداری از رفتارهای پرخطر جنسی[۱۵] در پیشگیری از سرطان موثرند.
روشهای درمان
روشهای اصلی درمان سرطان عبارتند از:
- شیمی درمانی
- پرتو درمانی
- جراحی
- ژن درمانی
- آنتیانجیوجنسیس
- تفکر مثبت
- هایپرترمیا
- درمان بیولوژیکی یا ایمونولوژیک: که مشتمل بر بازسازی، تحریک، هدایت و تقویت سیستم طبیعی دفاعی بدن بیمار است و با بکارگیری آنتی بادی و هدایت سیستم دفاعی خود بیمار جهت مبارزه با سرطان روی میدهد. بکارگیری عواملی مانند اینترفرون، سلولهایی که فعالیت ضدتوموری مستقیم دارند، و پادتنهای تکتیره رشد سرطان را کاهش میدهد.
- درمان فوتودینامیک (بکارگیری رنگ و نور): در این شیوه رنگ به داخل یک رگ تزریق و سپس در تمام بدن منتشر میشود. پس از چند روز، این رنگ تنها در سلولهای بدخیم باقی میماند. سپس نور قرمز رنگ لیزری به سلول تابانده میشود و رنگ درون سلول سرطانی این نور را جذب میکند. این امر منجر به واکنش فوتوشیمیایی که ویرانگر سلولها است میشود.
- سوزاندن ضایعه بدخیم با اشعه لیزر: در برخی موارد ضایعه بدخیم سرطان ریه منجر به مسدود شدن خشکنای میشود. در چنین موردی پزشک با سوزاندن ضایعه بدخیم با اشعه لیزر راه عبور هوا را برای بیمار باز میکند. این روش به گونه کامل نمیتواند منجر به ازبین بردن ضایعه بدخیم شود ولی کمکی است جهت آسان شدن تنفس در بیمار.
فیزیوتراپی در سرطان
سرطان یک بیماری عمومی است و میتواند علائم بسیاری از بیماریهای دیگر را که سرطان نبستند تقلید کند و وقتی که تشخیص سرطان داده شد آنوقت هر چه در بیمار اتفاق میافتد به سرطان نسبت داده میشود. چه بسیار بیماریهایی که در سرطانی وجود داشته و قابل معالجه بوده است و در اتوپی تشخیص داده شده است و اصولاً علت مرگ عوارض غیر قابل درمان نبوده است. باید به این گونه بیماریهای همراه توجه دقیق داشت درمان این عوارض گاهی سبب شده که بیمار مدتها زندگی راحتی داشته باشد. تشخیص به موقع این گونه عوارض کمک فوقالعادهای به بیمار میکند.
عوارض بیوشیمی سرطان: هیپرکلسمی، هیپوکلسمی، هیپوناترمی، کمبود پتاسیم، زیاد بودن پتاسیم، بالا بودن اسید اوریک، هیپر تیروئیدیسم، هیپرلپیدمی، هیپوگلیسمی، بالا رفتن آمیلاز سرم، اختلالات تغذیه و آب و الکترولیت
عوارض بالینی سرطان: سیستم قلب و عروق، سیستم تنفسی، سیستم ادراری، ضعف عضلانی، درد شدید، استئوپروز
عوارض جراحی در سرطان:برحسب محل جراحی این عوارض بسیار متنوع و متفاوت است.
عوارض شیمی درمانی، دارو درمانی و رادیو تراپی در سرطان:عوارض گوارشی، استئوپروز،، آتروفی عضلانی و عوارض دیگر
فیزیوتراپیست:دارای دانش فیزیولوژی و پاتوفیزیولوژی حرکت، دید کلی نگر(Holistic)، همچنین قابلیت بکار گیری درمانهای غیر دارویی و برنامه ریزی توانبخشی است که این مجموعه دانش فیزیوتراپی نامیده میشود.
اهداف فیزیوتراپی در سرطان:
- کاهش عوارض بیماری سرطان
- کاهش عوارض درمانهای سرطان
- راهاندازی و متحرک نگاه داشتن بیمار (کاهش عوارض بستری)
- حفظ استقلال بیمار
- کاهش درد بیمار
فیزیوتراپی با متدلوژی خاص خود میتواند نقش مراقبتی و حمایتی مناسبی برای بیماران سرطانی بو جود آورد. یک اصل کلی در فیزیوتراپی سرطان این است:بیمار تا آخرین لحظه زندگی بروی پای خود بایستد.
نزاری ناشی از سرطان
بیماران سرطانی به طور شایع دچار از دست دادن شدید چربی بدن و توده بدون چربی بدن و به دنبال آن ضعف شدید، بیاشتهایی و کمخونی میشوند. این نشانگان تحلیلبرنده نزاری نامیده میشود. علت اصلی نَزاری سرطان مشخص نیست با این حال شکی نیست که نزاری به علت نیازهای تغذیهای تومور ایجاد نمیشود. پژوهشهای اخیر نشان میدهد که کاشکسی در نتیجه عواملی مثل سیتوکینهای تولید شده توسط تومور و میزبان در پاسخ به تومور به وجود میآید.[۱۶]
آخرین پژوهشها
پژوهشگران پزشکی میگویند سلولهای داسیشکل ممکن است در اثر کمبودشان در خون، مجبور شوند که به سلولهای سرطانی تمورهایی که در برابر درمان مقاومت میکنند، حمله کنند. این سیستم روشی نو برای درمان سرطان گزارش شده است.[۱۷][۱۸]
استفاده از نانو روباتها جهت درمان سرطان
با شکل گیری نانوتکنولوژی امیدها برای درمان سرطان بیشتر شد، از آنجا که نانو ذرات از سلولهای بدن کوچکتر هستند میتوان این نوید را داد که در آینده نزدیک روباتهای نانومتری ای ساخته شوند که بتوانند در نابودسازی سلولهای سرطانی و تومورهای مغزی کمنک شایانی نمایند و بیشتر سرطانهای رایج را از بین ببرند، این نوع روش درمان هیچ گونه عوارض جانبی نخواهد داشت و دقیقا با مکانیزم سلولهای دفاعی بدن فعالیت میکنند و میتوان آنها را سلولهای مصنوعی نیز نامید، در حال حاضر پروژهای تحت عنوان نانوپردازنده (nanoprocessor) وظیفه تحقیق روی این روباتها را بر عهده گرفته است.
آمارها در ایران
محمداسماعیل اکبری، رییس مرکز تحقیقات سرطان ایران در تیرماه سال ۱۳۹۳ هجریشمسی گفت: ایران تقریبا بالاترین رشد سرطان را در جهان دارد. سرطان دومین عامل مرگ و میر در ایران است.[۱۹] ایرج حریرچی، معاون مدیریت منابع انسانی و توسعه وزارت بهداشت در سال ۱۳۹۲ آمار ابتلا به سرطان در ایران را سالانه ۹۰ هزار نفر و تعداد افراد مبتلا به سرطان در کشور را نیم میلیون نفر اعلام کرد و تخمین زد که طی ۱۵ تا سال ۲۰ آینده موارد ابتلا به سرطان به دو برابر افزایش یابد.[۲۰] سرطان معده، شایع ترین سرطان در مردان و سرطان پستان نیز شایع ترین سرطانها در زنان ایران شناخته شده است.[۲۱][۲۲]
دکتر بهزاد رحمانی رئیس هیئت مدیره انجمن علمی جراحان عمومی ایران، در شهریور ۱۳۹۳ ضمن تأیید افزایش تعداد مبتلایان به سرطان و کاهش سن مبتلایان در ایران گفت: «گفتن آمار سرطان در کشور، سیاه نمایی نیست بلکه واقع نمایی است». وی استرس، استفاده زیاد از افزودنیها و نگهدارندهها در مواد غذایی و همچنین آلودگی هوا را از دلایل افزایش سرطان دانست.[۲۳] دکتر عبدالله فضلعلی زاده، رئیس انجمن سرطان ایران از رشد فزاینده بیماران سرطانی در کشور بهعنوان یک سونامی ناگهانی نام میبرد و میگوید سرطان بهعنوان یکی از معضلات جامعه بشری با تهدید انسانها در تمام گروههای سنی سبب خسارت جانی و مالی فراوانی میشود که کشور ما نیز از این قاعده مستثنی نیست.[۲۴] سیدحسن قاضیزاده هاشمی در آبان ۱۳۹۳ در مطلبی که با عنوان «شیوع سرطان را جدی بگیریم» در وب سایت شخصی خود نوشت: «سرطان یک واقعیت تلخ است و علیرغم این که میزان ابتلای هموطنان عزیزمان به این بیماری در مقایسه با کشورهای اروپایی ۵ برابر کمتر است، اما روندی رو به رشد دارد؛ چنانکه وضعیت فعلی ما در این خصوص مشابه چند دهه قبل آنها است و باید این موضوع را جدی بگیریم».[۲۵]
بر اساس آمار منتشر شده توسط موسسه تحقیقات، درمان و آموزش سرطان براساس جمع کل زن و مرد در سال ۱۳۸۷، سرطان پوست با ۱۳٫۰۸٪، سرطان پستان با ۱۱٫۳۱٪ و سرطان معده با ۱۰٫۱۷٪ بیشترین موارد ابتلا را داشتند. همچنین بر اساس این آمار در مردان سرطان پوست، معده و مثانه و در زنان سرطان پستان و پوست بهترتیب بیشترین موارد ابتلا را داشتند.[۲۶]
2. ازمان بیماری مانند بیماری حاد ، تحت حاد و مزمن .
3. عضو درگیر شده مانند بیماریهای قلبی ، بیماریهای گوارشی و ریوی .
وبا
وَبا بیماری است که از طریق آب توسط باکتری ویبریو کلرا ایجاد میشود. این بیماری در گذشته در ایران به نام مرگامرگی خوانده میشدهاست. این باکتری با نوشیدن آب آلوده یا خوردن ماهی نپخته یا خوردن صدفها وارد بدن میشود. در ایران بیشترین راه انتقال وبا، سبزیهای آلودهاست. سبزیهایی که در هنگام کاشته شدن با کود انسانی (پساب) تغذیه میشوند دارای بیشترین آلودگی هستند. وبا در طول تاریخ هفت بار همهگیری جهانگستر داشتهاست. در قرن نوزدهم چندین بار در اروپا همهگیر شد اما امروزه وبا بیشتر در کشورهای جهان سوم به علت وضعیت ناسالم و غیر بهداشتی آبهای آشامیدنی دیده میشود.
محتویات
خاستگاه اپیدمیولوژیک وبا
وبا در آغاز بیماری مسری بخشهایی از شبه قاره هند در اطراف رود گنگ بودهاست. این بیماری از راه راههای بازرگانی (زمینی و دریایی) به روسیه و سپس به اروپای غربی و از اروپای غربی به آمریکای شمالی منتقل شد.
شناسایی باکتری وبا
- بیماری وبا برای نخستین بار به شکل علمی توسط پزشک پرتغالی، گارسیا ده اورتا در هندوستان در سال ۱۵۶۳ توصیف شد.
- جان اسنو پزشک مخصوص ملکه انگلستان، ارتباط میان وبا و آشامیدن آب را در سال ۱۸۵۴ کشف کرد.
- رابرت کخ پزشک آلمانی برای اولین بار در سال ۱۸۸۳ میلادی باکتری وبا را جداسازی کرد و شناسایی کرد. این باکتری، سی سال پیش از آن، بدست کالبدشناس ایتالیایی فیلیپ پاسینی جدا و شناسایی شده بود ولی نتایج کارهای وی ناشناخته بود. جان اسنو و رابرت کخ نتیجه آزمایشهای پیشین پاسینی را نمیدانستند و برای این کشف سرشناس شدند.
نشانههای بیماری
آغاز ناگهانی اسهال آبکی شدید و بدون درد و تب از نشانههای بیماری وبا است. اسهال وبا به اسهال آب برنجی معروف است وفرد بیمار گاه روزانه بیش از ۳۰لیتر آب دفع میکند که این مقدار دفع آب باعث اسیدوز و نهایتاً میتواند منجر به مرگ فرد شود. کمتر از ۵٪ بیماران وبایی تب دارند. گاهی در آغاز بیماری استفراغ دیده میشود. بیمار احساس تشنگی دارد و بیقرار است از درد پشت ساق پا شاکی است، زبان خشک، چشمها گودرفته، نبض ناتوان است.
- تشنگی زیاد
- استفراغ بدون حالت تهوع
- اسهال آبکی و پرفشار و بدون دلدرد که بیمار نتواند آن را کنترل کند.
- گرفتن ماهیچههای پشت ساق پا
- کم شدن ادرار
- ادرار با رنگ زرد
البته باید توجه داشته باشید که هر کدام از این موارد بالا به تنهایی نشانگر وبا نیستند یک فرد ممکن است همه نشانههای بالا را نداشته باشد. مدت زمان بروز بیماری از ۲ تا ۵ روز متغیر است.
پیشگیری
اگرچه بیماری وبا میتواندمرگ آور باشد، میتوان به آسانی از آن پیشگیری کرد. در ایالات متحده آمریکا و اروپای غربی به علت استفاده از سیستمهای آب و دفع پساب پیشرفته، وبا تهدید مهمی نمیباشد.
مهمترین روش پیشگیری دفع مناسب پساب و جلوگیر از ورود آنها به منابع آب آشامیدنی است. تصفیه، جوشاندن و کلریده کردن آب از مدتها قبل روش مناسبی برای جلوگیری از سرایت این بیماری است.
شیر و غذاهای آماده باید پس از گرم کردن مصرف شود. از بین بردن حشرات و دور نگهداشتن مواد غذایی از دسترس مگس، گندزدایی سبزی و میوه جات با محلول پرکلرین یک در ۱۰ هزار به کنترل بیماری کمک میکند. اولین قدم در کنترل بیماری وبا، تشخیص سریع بالینی و آزمایشگاهی و جدا کردن بیماران و افراد ناقل است. وسایل بیمار باید به طور کامل گندزدایی شود. رعایت کامل جداکردن (ایزولاسیون) در مورد بیمار به عمل آید و ملاقات او ممنوع شود.
درمان
نخسنین مرحله درمان، نوشاندن آب و الکترولیتها به بیمار است. گام سپسین، دادن آنتیبیوتیک است که هم کمک به کاهش حجم مدفوع میکند و هم مدت بیماری را کوتاه میکند و همچنین سیکل انتقال را کوتاه و قطع میکند.
برای نوشاندن آب و الکترولیت توجه به شدت اسهال و وضع کم آبی بیمار لازم است. در اسهالهای خفیف و دهیدراتاسیون خفیف (زیر ۵٪) دادن آب و الکترولیت خوراکی (ORS) کافی است اگر موجود نبود و یا بیمار تحمل نکرد میتوان از لعاب برنج (۵۰ گرم در لیتر)، نوشابه با نمک و... استفاده کرد.
در بیماران با دهیدراسیون شدید (که بیش از ۱۰٪ آب از دست دادهاند؛ درای چشمهای کاملاً گودرفته، خواب آلوده، فشار خون و نبض ضعیف) و همچنین در بیمارانی که استفراغ دارند و یا در بیمارانی که در اغما هستند و همچنین بیماران دارای فلج روده باید سرم تزریق شود.
آنتی بیوتیک تتراسایکلین و داکسی سیکلین نقش مهمی در کاهش مدت و شدت بیماری وبا دارند. سایر آنتی بیوتیکهایی که بهرهگیری میشوند دربرگیرنده سیپروفلوکساسین و آزیترومایسین میباشند. برای کودکان و زنان باردارسیفیکسیم، آمپی سیلین، آزیترومایسین و اریترومایسین مناسب است.
واکسن وبا
واکسنهای ساخته شده از باکتری کشته شده در زیر پوست مصونیتی کوتاه مدت ایجاد میکند. واکسن خوراکی با میکروب کشته شده دارای انواع مختلف است و حدوداً در ۵۰٪ موارد مؤثر است و مدت دوام واکسن حدود ۳ سال است نوع دیگر واکسن با میکروب زنده ضعیف شدهاست که در دست بررسی میباشد. بهطور معمول و یا به طورکلی واکسن به عنوان پیشگیری وبا توصیه نمیشود و رعایت نکات بهداشتی برای جلوگیری وبا کافی است
سم وبا و مکانیسم بیماری
سم باکتری ویبریو کلرا کُلُراژن (Choleragen) یا زهرابهٔ وبا (Cholera Toxin) نامیده میشود. سم کلرا مهمترین ساز و کارها اصلی بیماریزایی باکتری ویبریو کلرا محسوب میشود. این سم از نوع انتروتوکسین میباشد. وقتی باکتری ویبریو کلرا از معده گذشته و به دوازدهه که جایگاه حساس باکتری است میرسد به قشر مخاطی نفوذ کرده و به سلولهای پوششی و پرزهای دوازدهه میچسبد و پس از چسبیدن به پرزهای دوازدهه و تکثیر زیاد، ۷۰ سانتیمتر ابتدای رودهٔ کوچک را میپوشانند. باکتری ویبریو کلرا پس از تکثیر در روده، پاره شده و درونمایه آن که همان زهرابه یا سم وبا است وارد روده میشود. زهرابهٔ وبا در روده سبب افزایش cAMP (سیکلیک اِ اِم پی) شده که خود سبب افزایش تراوش آب و الکترولیت به درون روده میشود و همچنین از جذب الکترولیتها جلوگیری میکند.
آسیبپذیری به باکتری وبا
باکتری ویبریو کلرا بطور معمولی میتواند باعث ایجاد بیماری وبا در افراد سالم گردد، گرچه افزایش آسیبپذیری بدن افراد با ضعیف شدن سیستم ایمنی بدن رابطه دارد. افرادی که معده آنها بخاطر استفاده داردوهای ضد اسیدی (مانند رانیتیدین، سایمتیدین، امپرازول) یا تغذیه نامناسب کمتر اسیدی است، به این بیماری آسیبپذیرتر هستند. پژوهشهای همهگیرشناختی اخیر نشان میدهد که آسیبپذیری افراد به بیماری وبا با نوع و گروه خونی آنها ارتباط دارد. افرادی که گروه خونی O دارند بیشترین آسیبپذیری نسبت به این بیماری دارند.
چرخه زیستی باکتری وبا
مخزن اصلی وبا انسان است؛ ولی با تازگی ثابت گردیده که بطور طبیعی در جانداران ریز آب (پلانکتونها) در محل ورود رودخانه به دریا و در آبهای کمی شور مزه نیز وجود دارد. باکتری ویبریو کلرا بطور طبیعی بر روی پلانکتونهای آب شیرین، آب کمی شور و آب دریا زندگی میکند. این منابع آب به ویبریو کلرا آلوده هستند و مواد غذایی شسته شده در آین آبها و صدفهایی که در آن آبها زندگی میکنند، را آلوده میکند و میتوانند سپس به انسان منتقل شوند.
وبا در ایران
- سال ۱۳۴۴ همهگیری (اپیدمی) وبا در ایران رخ داد و ایران منطقه آندمیک وبا شد اولین سروتایپ شناسایی شده در ایران سروتایپاوگاوا بود.
- سروتایپ اینهابا اوایل سال۵۰ در ایران دیده شد و سپس بهطور متناوب تا سال ۱۳۵۶ اینهابا و اوگاوا در ایران دیده میشد. پس از سال ۱۳۵۶ تقریباً تمام موارد در ایران اوگاوا بود.
- در ایران از سال ۷۹ تا ۸۴ سالانه نزدیک به ۱۰۰ مورد بیماری وبا گزارش گردیدهاست. (در اپیدمی ۱۳۷۷ حدود ۱۱۰۰۰ مورد وبا در ایران گزارش گردید؛ که تقریباً در تمام موارد میکروب از نوع التور سروتایپ اوگاوا بودهاست)
قربانیان نامی وبا
- چایکوفسکی یک هفته پس از آغاز سمفونی شماره ۶ او به دلیل بیماری وبا درگذشت.
سل
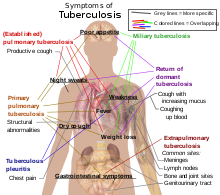
سل (به انگلیسی: Tuberculosis) یک بیماری عفونی شایع، و در بسیاری از موارد مرگبار است. این بیماری توسط گونههای مختلف میکوباکتریا، به طور معمول «مایکوباکتریوم توبرکلوزیس» ایجاد میشود.[۱] سل به طور معمول به ریهها حمله میکند، اما بر قسمتهای دیگر بدن نیز میتواند تأثیر گذار باشد. وقتی افرادی که عفونت سلی فعال دارند سرفه، عطسه، و یا بزاق خود را از طریق هوا منتقل میکنند سل از طریق هوا پخش میشود.[۲] اغلب عفونتها بدون علامت و پنهان هستند. اما معمولاً از هر ده عفونت نهفته یک عفونت در نهایت پیشرفت کرده و به بیماری فعال تبدیل میشود. اگر سل درمان نشود، بیش از ۵۰٪ از افرادی که به آن آلوده میشوند را به کام مرگ میکشد.
علائم کلاسیک عفونت سل فعال عبارتند از سرفه مزمن با خلط آغشته به خون، تب، تعریق شبانه، و کاهش وزن. (سل قبلاً به دلیل کاهش وزن افراد به «زوال» مبتلا معروف بود.) عفونت اندامهای دیگر باعث طیف وسیعی از علائم میشود. تشخیص سل فعال به رادیولوژی (معمولاً عکس از قفسه سینه با X-ray) و همچنین آزمایشهای میکروسکوپی و کشت میکروبیولوژیک مایعات بدن متکی است. تشخیص سل نهفته متکی بر تست پوستی توبرکولین (TST) و آزمایش خون میباشد. درمان دشوار است و مستلزم آن است که آنتی بیوتیکهای متعددی در یک مدت زمان طولانی استفاده شوند. ارتباطات اجتماعی نیز غربالگری و در صورت لزوم مورد درمان قرار میگیرند. مقاومت در برابر آنتی بیوتیکها یک مشکل رو به رشد در عفونتهای سل مقاوم در برابر داروهای چندگانه (MDR-TB) میباشد. برای جلوگیری از سل، مردم باید برای این بیماری غربالگری و با واکسن bacillus Calmette-Guérin واکسینه شوند.
کارشناسان معتقدند که یک سوم از جمعیت جهان مبتلا به «M. tuberculosis» هستند،[۳] و در هر ثانیه یک نفر به این تعداد افزوده میشود.[۳] در سال ۲۰۰۷، ۱۳٫۷ میلیون مورد مزمن در سطح جهان فعال بودند.[۴] در سال ۲۰۱۰، حدود ۸٫۸ میلیون مورد جدید به وجود آمده و ۱٫۵ میلیون مورد به مرگ انجامید، که عمدتاً در کشورهای در حال توسعه رخ داده است.[۵] تعداد مطلق موارد ابتلا به سل از سال ۲۰۰۶ رو به کاهش بوده است، و موارد جدید از سال ۲۰۰۲ کاهش یافته است.[۵] سل به طور یکنواخت در سراسر جهان توزیع نشده است. تست توبرکولین حدود ۸۰٪ از جمعیت حاضر در بسیاری از کشورهای آسیایی و آفریقایی مثبت بوده است، اما تنها تست ۵-۱۰٪ از جمعیت ایالات متحده مثبت بوده است.[۱] مردم کشورهای در حال توسعه به دلیل کمبود ایمنی، بیشتر در معرض خطر سل قرار دارند. به طور معمول، این افراد به دلیل آلوده بودن به HIV و ابتلا به ایدز گرفتار سل میشوند.[۶]
محتویات
علائم و نشانهها
حدود ۵–۱۰٪ از افرادی که HIV ندارند، اما آلوده به سل هستند در طول عمر خود دچار بیماری فعال میشوند.[۸] در مقابل، ۳۰٪ از افرادی که آلوده به HIV و سل هستند دچار بیماری فعال میگردند.[۸] سل میتواند هر قسمتی از بدن را آلوده کند، اما معمولاً در ریهها رخ میدهد (شناخته شده به عنوان سل ریوی).[۹] سل خارج ریوی زمانی رخ میدهد که سل به خارج از ریهها نفوذ میکند. سل خارج ریوی همچنین میتواند همزمان با سل ریوی وجود داشته باشد.[۹] علائم و نشانههای عمومی عبارتند از تب، لرز، تعریق شبانه، از دست دادن اشتها، کاهش وزن، و خستگی.[۹] همچنین پدیده انگشت چماقی قابل توجهی نیز میتواند رخ دهد.[۸]
ریوی
اگر یک عفونت سل فعال شود، در حدود ۹۰٪ از مردم در ریهها بروز میکند.[۶][۱۰] علائم میتواند شامل درد قفسه سینه و سرفههای طولانی باشد که تولید خلط میکنند. در حدود ۲۵٪ از افراد هیچ علائمی ندارند (یعنی آنها «بدون علامت» باقی میمانند).[۶] گاهی اوقات، افراد دچار سرفههای خونین در مقادیر کم میشوند. در موارد نادر، عفونت میتواند به تضعیف شریان ریوی بینجامد، که منجر به خونریزی شدید به نام آنوریسم راسموسن میشود. سل میتواند تبدیل به یک بیماری مزمن شده و باعث زخمهای گسترده در نرمه فوقانی ریهها شود. قسمت فوقانی ریهها بیشتر تحت تأثیر قرار میگریند.[۹] دلیل آن به طور کامل روشن نیست.[۱] شاید قسمت فوقانی ریهها به دلیل جریان هوای بهتر[۱] یا خروجی ضعیف غدد لنفاوی بیشتر تحت تأثیر قرار میگیرند.[۹]
خارج ریوی
در ۱۵–۲۰٪ از موارد فعال، عفونت به خارج از اندامهای تنفسی گسترش مییابد که باعث بروز انواع دیگر سل میشود[۱۱] به سلی که خارج از اندامهای تنفسی رخ میدهد، «سل خارج ریوی» گفته میشود.[۱۲] سل خارج ریوی به طور معمول در افرادی که دچار نقص سیستم ایمنی هستند و کودکان رخ میدهد. سل خارج ریوی در بیش از ۵۰٪ از افرادی که HIV دارند دیده میشود.[۱۲] مکانهای عفونت قابل توجه خارج ریوی عبارتند از: شش شامه (در پلورزی (آماس شامه ریه) سلی)، سیستم عصبی مرکزی (در مننژیت سلی)، و سیستم لنفاوی (در سل غدد لنفاوی گردن). از میان مکانهای دیگر سل خارج ریوی در دستگاه ادراری تناسلی (در سل ادراری تناسلی) و در استخوانها و مفاصل (در سل ستون فقرات) نیز اتفاق میافتد. هنگامی که این بیماری در استخوان هم گسترش مییابد، آن را به عنوان «سل استخوانی» نیز میشناسند،[۱۳] که نوعی از استئومیلیت (کورک استخوانی) میباشد.[۱] یک نوع بالقوه جدی تر و شایع سل، سل «منتشر» نام دارد، که معمولاً به عنوان سل ارزنی یا میلیاری شناخته شده است.[۹] سل ارزنی در حدود ۱۰٪ از موارد سل خارج ریوی را تشکیل میدهد.[۱۴]
علل
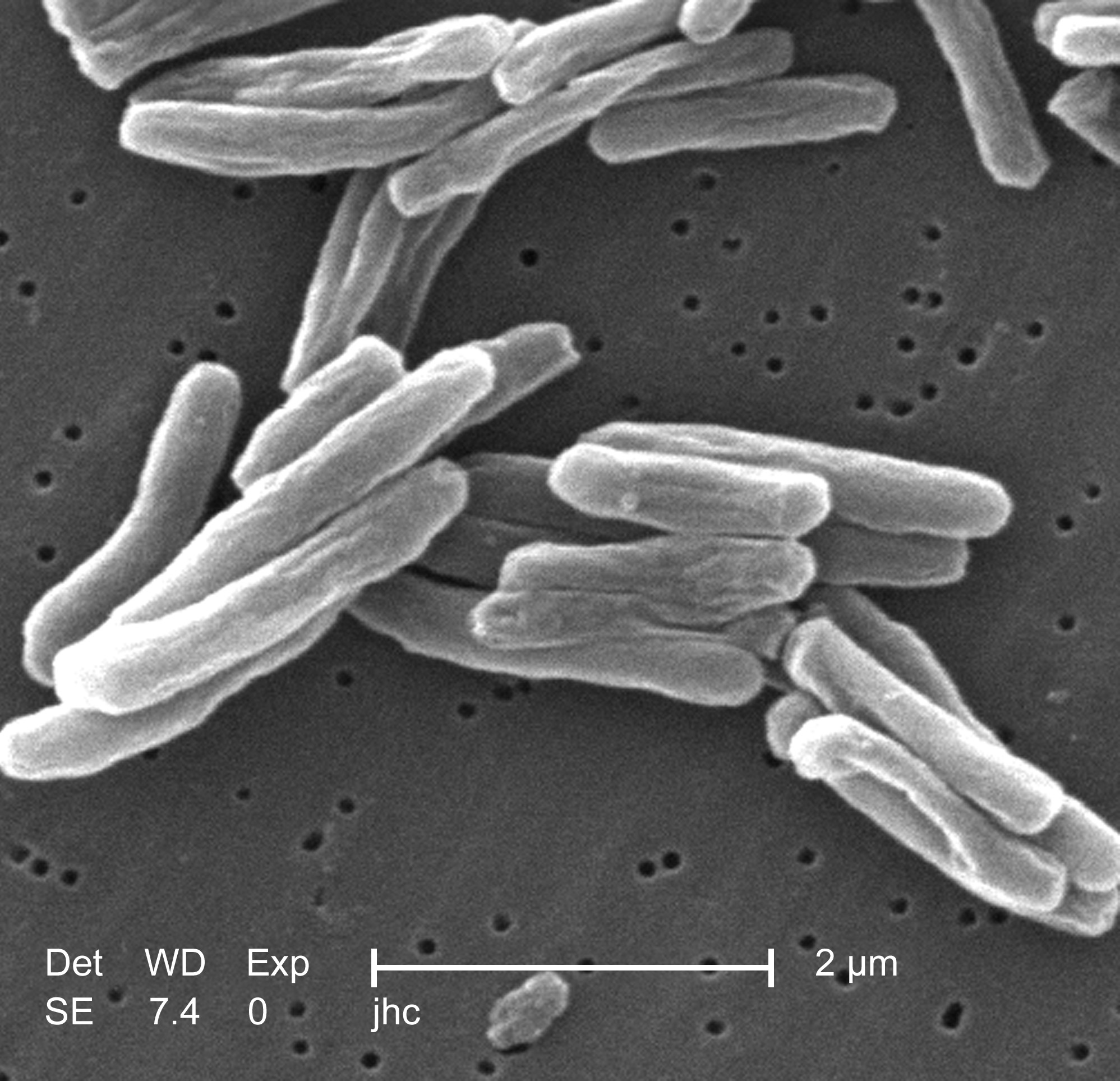
مایکوباکتری
علت اصلی سل «مایکوباکتریوم توبرکلوزیس»، یک باسیل بی حرکت هوازی کوچک است.[۹] بسیاری از ویژگیهای بالینی منحصربهفرد این پاتوژن به دلیل محتوای چربی بالای آن ایجاد میشود.[۱۵] این باسیل هر ۱۶ –۲۰ ساعت یک بار تقسیم میشود. سرعت آن در مقایسه با دیگر باکتریها که معمولاً در کمتر از یک ساعت تقسیم میشوند آهسته است.[۱۶] غشای بیرونی میکوباکتریا از دولایه لیپیدی تشکیل شده است.[۱۷] اگر یک رنگ آمیزی گرم انجام شود، MTB یا رنگ بسیار کم «گرم مثبت» دارد یا اصلاً رنگی به خود نمیگیرد چرا که دیواره سلولی آن دارای محتوای چربی و اسید مایکولیک بالا میباشد.[۱۸] MTB میتواند در برابر مواد ضد عفونی کننده ضعیف مقاومت کند و میتواند در یک شرایط خشک هفتهها زنده بماند. در طبیعت، باکتری تنها میتواند در داخل سلول یک ارگانیسم میزبان رشد کند، اما «M. tuberculosis» میتوان در آزمایشگاه کشت شود.[۱۹]
با استفاده از رنگهای بافتی بر روی نمونههای بلغم به دست آمده از سینه، دانشمندان میتوانند MTB را در زیر یک میکروسکوپ معمولی (نوری) تشخیص دهند. (بلغم، «خلط» نیز نامیده میشود.) MTB رنگهای خاصی را حتی بعد از واکنش با محلول اسیدی حفظ میکند، بنابراین به عنوان باسیل اسید-فاست (مقاوم در برابر رنگ بری اسید) (AFB) طبقه بندی شده است.[۱][۱۸] دو تکنیک رنگ آمیزی اسید فاست شایع تر هستند: رنگ آمیزی Ziehl–Neelsen، که AFBها را به رنگ قرمز روشن در میآورد که به وضوح در برابر یک پس زمینه آبی رنگ دیده میشوند،[۲۰] و رنگ آمیزی auramine-rhodamine و پس از آن میکروسکوپ فلورسانس.[۲۱]
مجموعه «M. tuberculosis»(MTBC) شامل چهار میکوباکتری سل زای دیگر میشود: “M. bovis,” “M. africanum,” “M. canetti,” و “M. microti”.[۲۲] «M. africanum»شایع نیست، اما علت قابل توجه ایجاد سل در بخشهایی از آفریقا میباشد.[۲۳][۲۴] «M. bovis» یک علت شایع سل بود، اما با ظهور شیر پاستوریزه تا حد زیادی این میکوباکتریوم را به عنوان یک مشکل بهداشت عمومی در کشورهای توسعه یافته از بین برد.[۱][۲۵] «M. canetti» نادر است و به نظر میرسد به شاخ آفریقا محدود باشد، اگر چه چند مورد در مهاجران آفریقایی دیده شده است.[۲۶][۲۷] «M. microti» نیز نادر بوده و اغلب در افراد دارای نقص ایمنی دیده میشود، اما این پاتوژن میتوانست شایع تر از آن باشد که ما فکر میکنیم.[۲۸]
دیگر میکوباکتریهای بیماری زای شناخته شده عبارتند از “M. leprae,” “M. avium,” و “M. kansasii”. دو گونه آخر به عنوان «میکوباکتریهای غیر سلی» (NTM) طبقه بندی شدهاند. NTM باعث ایجاد سل یا جذام نمیشود، اما آنها منجر به بیماریهای ریوی میشوند که شبیه سل است.[۲۹]
عوامل خطر ساز
عوامل متعددی مردم را بیشتر مستعد ابتلا به عفونت سل مینمایند. مهم ترین عامل خطر ساز در سراسر جهان HIV است؛ ۱۳٪ درصد از تمام موارد ابتلا به سل آلوده به ویروس HIV هستند.[۵] این مشکل در کشورهای جنوب صحرای آفریقا، که در آن نرخ HIV بالاست شایع است.[۳۰][۳۱] سل به ازدحام بیش از حد و تغذیه نامناسب بسیار مرتبط است. این ارتباط باعث میشود سل یکی از بیماریهای فقر اصلی باشد.[۶] این دسته از افراد در معرض خطر بالایی برای عفونت سل قرار دارند: افرادی که مواد مخدر ممنوع تزریق میکنند، ساکنان و کارگران و کارمندان مکانهایی که در آن افراد آسیب پذیر تجمع میکنند (به عنوان مثال، زندانها و پناهگاههای مخصوص بی خانمانها)، افرادی که فقیر هستند و به مراقبتهای پزشکی مناسب دسترسی ندارند، اقلیتهای قومی با خطر بالا، بچهها در تماس نزدیک با افراد با خطر بالا، و ارائه دهندگان مراقبتهای بهداشتی که در خدمت این افراد میباشد.[۳۲] بیماری ریوی مزمن، یکی دیگر از عوامل خطر ساز قابل توجه است. بیماری سیلیکوز خطر را حدوداً ۳۰ برابر میکند.[۳۳] افرادی که سیگار میکشند نسبت به غیر سیگاریها تقریباً دو برابر در معرض خطر ابتلا به سل هستند.[۳۴] بیماریهای دیگر نیز میتوانند خطر ابتلا به سل را افزایش دهند، از جمله اعتیاد به الکل[۶] و دیابت قندی (خطر را سه برابر میکند).[۳۵] برخی داروها، مانند کورتیکواستروئیدها و اینفیلیکسیماب (یک آنتی بادی مونوکلونال ضد αTNF)، به خصوص در جوامع توسعه یافته از عوامل خطر ساز بسیار مهم هستند.[۶]همچنین، یک استعداد ژنتیکی[۳۶] نیز وجود دارد، اما دانشمندان مشخص نکردهاند که چقدر مهم است.[۶]
مکانیسم
انتقال
هنگامی که افراد مبتلا به سل فعال آواز بخوانند، سرفه، عطسه، صحبت، یا تف کند، آنها قطرات عفونی معلق در هوا به قطر ۰٫۵ تا ۵ میکرومتر را پخش میکنند. تنها یک عطسه میتواند تا ۴۰٬۰۰۰ قطره را منتشر کند.[۳۷] هر قطره میتواند بیماری را منتقل کند زیرا دوز عفونی سل بسیار پایین است. (کسی که کمتر از ۱۰ باکتری را استنشاق کند میتواند آلوده شود).[۳۸]
مردمی که در تماسهای طولانی مدت، مکرر، یا نزدیک با افراد مبتلا به سل هستند در معرض خطر آلوده شدن به عفونت، با نرخ عفونت حدود ۲۲ درصد میباشند.[۳۹] یک فرد مبتلا به سل فعال، اما درمان نشده میتواند ۱۰-۱۵ نفر (یا بیشتر) را در هر سال آلوده کند.[۳] به طور معمول، تنها افراد دارای سل فعال این بیماری را انتقال میدهند. تصور نمیشود که افراد مبتلا به عفونت نهفته مسری باشند.[۱] احتمال انتقال از فردی به فرد دیگر به عوامل متعددی بستگی دارد. این عوامل عبارتند از تعداد قطرات عفونی که حامل منتشر میکند، کارآمدی تهویه محیط زیست افراد، مدت زمان در معرض قرار گرفتن، میزان واگیردار بودن گونه «M. tuberculosis»، و سطح ایمنی در فرد غیرآلوده.[۴۰] برای جلوگیری از آبشار شیوع فرد به فرد، افراد مبتلا به سل فعال («آشکار») را جدا کنید و آنها را تحت رژیمهای داروی ضد سل قرار دهید. پس از حدود دو هفته درمان مؤثر، به طور کلی افراد مبتلا به عفونت فعال غیر مقاوم برای دیگران مسری نخواهند بود.[۳۹] اگر کسی آلوده شود، به طور معمول سه تا چهار هفته طول میکشد تا شخص به تازگی آلوده شده به اندازه کافی برای انتقال بیماری به دیگران مسری شود.[۴۱]
بیماری زایی
در حدود ۹۰٪ درصد از افرادی که مبتلا به «M. tuberculosis» هستند عفونت سل نهفته بدون علامت دارند (که گاهی اوقات LTBI نامیده میشود).[۴۲] این افراد در طول عمر خود تنها ۱۰٪ شانس پیشرفت عفونت نهفته به بیماری سل فعال آشکار را دارند.[۴۳] برای افراد مبتلا به HIV، خطر اینکه آنها به سل فعال مبتلا شوند به نزدیک ۱۰٪ در سال میرسد.[۴۳] اگر درمان مؤثر داده نشود، میزان مرگ و میر در موارد سل فعال تا ۶۶٪ میباشد.[۳]
عفونت سل وقتی که میکوباکتریها به حبابچههای ریوی میرسد شروع میشود، جایی که آنها به endosomes از ماکروفاژهای آلوئولی حمله کرده و در داخل آن تکثیر میشوند.[۱][۴۴] محل اولیه عفونت در ریهها، معروف به «کانون گان»، یا در قسمت فوقانی لوب تحتانی، یا در قسمت تحتانی لوب فوقانی واقع شده است.[۱] سل ریهها میتواند از طریق عفونت از جریان خون نیز ایجاد شود، که به عنوان کانون سیمون شناخته شده است. یک عفونت کانون سیمون به طور معمول در بالای ریه دیده میشود.[۴۵] این انتقال خونی میتواند بیماری را به محلهای دور تر از جمله غدد لنفاوی محیطی، کلیهها، مغز، و استخوانها نیز گسترش دهد.[۱][۴۶] سل بر تمام قسمتهای بدن تأثیر میگذارد، هر چند به دلایل نامعلوم به ندرت قلب، عضلات اسکلتی، لوزالمعده، یا تیروئید را تحت تأثیر قرار میدهد.[۴۷]
سل به عنوان یکی از بیماریهای التهابی گرانولومــاتوز دسته بندی میشود. ماکروفاژها، T لنفوسیتها، B لنفوسیتها، و فیبروبلاستها از جمله سلولهایی هستند که جمع میشوند تا گرانولومها را تشکیل دهند. لنفوسیتها ماکروفاژهای آلوده را احاطه میکنند. گرانولوم از انتشار میکوباکتریها جلوگیری کرده و یک محیط محلی را برای تعامل سلولهای سیستم ایمنی بدن فراهم مینماید. باکتریها در داخل گرانولوم میتوانند ساکت بمانند، که منجر به عفونت نهفته میشود. یکی دیگر از ویژگیهای گرانولومها توسعه مرگ سلولی غیر طبیعی (نکروز) در مرکز برآمدگیها است. برای چشم غیر مسلح، این نکروز، بافتی نرم، شبیه پنیر سفید دارد و نکروز پنیری نامیده میشوند.[۴۸]
باکتریهای سل میتوانند از یک منطقه آسیب دیده بافت وارد جریان خون شود. آنها میتوانند در سراسر بدن گسترش یافته و کانونهای متعدد عفونت را ایجاد کنند، که مانند برآمدگیهای کوچک سفید در بافتها دیده میشوند.[۴۹] این نوع شدید از بیماری سل سل ارزنی نامیده میشود. این شکل از سل بیشتر در کودکان و افراد مبتلا به HIV شایع است.[۵۰] افراد مبتلا به سل منتشر، حتی با درمان هم میزان مرگ و میر بالایی دارند (حدود ۳۰٪).[۱۴][۵۱]
در بسیاری از مردم، عفونت ظهور و افول دارد. تخریب و نکروز بافت اغلب با بهبود و فیبروز متعادل میشود.[۴۸] بافت متأثر، با جای زخم و حفرههای پر شده با مواد نکروز پنیری جایگزین میشود. در بیماری فعال، برخی از این حفرهها به راههای هوایی نایژهها پیوسته و این مواد میتوانند با سرفه کردن بیرون بریزند. این مواد حاوی باکتری زنده هستند و میتوانند عفونت را پخش کنند. درمان با آنتی بیوتیکهای مناسب، باکتریها را میکشد و امکان بهبودی را فراهم میکند. هنگامی که بیماری درمان شد، مناطق آسیب دیده توسط بافتهای همبند جای زخم جایگزین میشوند.[۴۸]
تشخیص
سل فعال
تشخیص سل فعال صرفاً بر اساس علائم و نشانهها دشوار است.[۵۲] همچنین تشخیص بیماری در افرادی که دچار دپرسیون ایمنی هستند نیز مشکل است.[۵۳] با این حال، افرادی که دارای علائم بیماری ریوی یا علائم مزاجی هستند که بیش از دو هفته ادامه مییابند ممکن است سل داشته باشند.[۵۳] یک عکس از قفسه سینه با پرتو ایکس و چند کشت خلط برای باسیلهای اسید فاست به طور معمول بخشی از ارزیابی اولیه میباشند.[۵۳] آزمونهای اینترفرون گاما ترشح شده (IGRAها) و آزمونهای پوستی توبرکولین در جوامع در حال توسعه مفید نیستند.[۵۴][۵۵] IGRAها در افراد مبتلا به HIV نیز محدودیتهای مشابهی دارند.[۵۶][۵۷]
یک تشخیص قطعی سل زمانی انجام میشود که «M. tuberculosis» در یک نمونه بالینی شناسایی شود (برای مثال، خلط چرک، یا یک بیوپسی از بافت). با این حال، روند دشوار کشت برای این ارگانیسم دارای رشد آهسته میتواند دو تا شش هفته برای کشت خون یا خلط طول بکشد.[۵۸] از این رو، درمان اغلب قبل از تأیید کشتها آغاز میشود.[۵۹]
آزمونهای تقویت اسید نوکلئیک و آزمایش آدنوزین آمیناز میتوانند سل را به سرعت تشخیص دهند.[۵۲] با این حال، این آزمایشها به طور مداوم توصیه نمیشوند چرا که آنها به ندرت چگونگی درمان یک فرد را تغییر میدهند.[۵۹] آزمایش خون برای تشخیص آنتی بادیها دقیق یا حساس نیستند، بنابراین توصیه نمیشوند.[۶۰]
سل نهفته
تست پوستی توبرکولین مانتو اغلب برای غربالگری افراد در معرض خطر بالای بیماری سل استفاده میشود.[۶۱] این تست میتواند در افراد مبتلا به سارکوئیدوز، لنفوم هوچکین، و سوء تغذیه به صورت کاذب منفی باشد. مهمتر از همه، این تست میتواند در افرادی که سل فعال دارند به صورت کاذب منفی باشد.[۱] سنجش اینترفرون گامای آزاد (IGRAها) در یک نمونه خون برای افرادی که تست مانتو مثبت دارند توصیه میشود.[۵۹] IGRAها تحت تأثیر ایمن سازی یا اکثر میکوباکتریهای زیست محیطی قرار نمیگیرند، بنابراین آنها نتایج مثبت کاذب کمتری ارائه میکنند.[۶۲] با این حال آنها تحت تأثیر «M. szulgai»، «M. marinum» و «M. kansasii» قرار میگیرند.[۶۳] IGRAها زمانی که همراه با تست پوستی استفاده میشوند میتوانند حساسیت بیشتری داشته باشند. اما وقتی IGRAها به تنهایی استفاده میشوند میتوانند حساسیت کمتری نسبت به تست پوستی داشته باشند.[۶۴]
پیشگیری
تلاش برای جلوگیری و کنترل سل بر واکسیناسیون نوزادان و تشخیص و درمان مناسب موارد فعال متکی میباشد.[۶] سازمان بهداشت جهانی (WHO) موفقیتهایی را در رژیمهای درمانی بهبود یافته به دست آورده است. کاهش کوچکی در تعداد موارد دیده شده است.[۶]
واکسنها
تا سال ۲۰۱۱، تنها واکسن سل موجود(Bacillus Calmette-Guérin یا ب.ث.ژ) میباشد. BCG در برابر بیماریهای منتشر شده در دوران کودکی مؤثر است، اما حفاظت متناقضی را در برابر ابتلا به سل ریوی ایجاد میکند.[۶۵] با این حال، این گستردهترین واکسن مورد استفاده در سراسر جهان است، که بیش از ۹۰٪ از همه کودکان را واکسینه میکند.[۶] با این حال، ایمنی ایجاد شده توسط آن بعد از حدود ده سال کاهش مییابد.[۶] سل در اکثر نقاط کانادا، بریتانیا، و ایالات متحده شایع نیست، بنابراین BCG فقط برای افرادی که در معرض خطر بالا قرار دارند استفاده میشود.[۶۶][۶۷][۶۸] یکی از دلایل عدم استفاده از واکسن این است که باعث میشود تست پوستی توبرکولین مثبت کاذب شود، که این آزمون را برای غربالگری این بیماری بی فایده مینماید.[۶۸] واکسنهای جدید در دست تهیه هستند.[۶]
بهداشت عمومی
سازمان جهانی بهداشت در سال ۱۹۹۳ سل را «وضعیت اضطراری برای بهداشت جهانی» اعلام کرد.[۶] در سال ۲۰۰۶، مشارکت توقف سل، طرح جهانی برای متوقف کردن سل را مطرح کرد که قرار است تا سال ۲۰۱۵ جان ۱۴ میلیون نفر را حفظ کند.[۶۹] تعدادی از اهداف تعیین شده به احتمال زیاد تا سال ۲۰۱۵ حاصل نمیشوند، این امر بیشتر به دلیل افزایش سل مرتبط با HIV و ظهور سل مقاوم در برابر چند دارو (MDR-TB) میباشد.[۶] سیستم طبقه بندی سل که جامعه بیماریهای صدری آمریکا آن را تهیه کرده است در برنامههای بهداشت عمومی استفاده میشود.[۷۰]
مدیریت
درمان سل از آنتی بیوتیکها برای از بین بردن باکتریها استفاده میکند. درمان مؤثر سل مشکل است که به دلیل ساختار غیر معمول و ترکیب شیمیایی دیواره سلولی میکوباکتریومی میباشد. دیواره سلولی داروها را بیرون نگه میدارد و باعث میشود که بسیاری از آنتی بیوتیکها بی اثر شوند.[۷۱] دو آنتی بیوتیکی که بیشترین استفاده را دارند ایزونیازید و ریفامپیسین هستند و درمان میتواند ماهها ادامه یابد.[۴۰] در درمان سل نهفته معمولاً تنها از یک آنتی بیوتیک استفاده میشود.[۷۲] بیماری سل فعال، به منظور کاهش خطر ایجاد مقاومت در برابر آنتی بیوتیک در باکتری، با ترکیبی از چند آنتی بیوتیک بهتر درمان میشود.[۶] افراد مبتلا به عفونت نهفته نیز درمان میشوند تا از ابتلای آنها به بیماری سل فعال در آینده جلوگیری شود.[۷۲] WHO درمان با مشاهده مستقیم را توصیه میکند. در این روش درمانی، ارائه دهنده مراقبتهای بهداشتی مصرف دارو توسط فرد را مشاهده مینماید. هدف کاهش تعداد افرادی است که آنتی بیوتیکها را به طور مناسب مصرف نمیکنند.[۷۳] با این حال، شواهد برای حمایت از درمان با مشاهده مستقیم ضعیف است.[۷۴] روشهایی که به مردم یادآوری میکند که درمان بسیار مهم است مؤثر میباشند.[۷۵]
شروع جدید
در سال ۲۰۱۰، درمان توصیه شده برای سل ریوی تازه بروز کرده، ترکیبی از آنتی بیوتیکها به مدت شش ماه میباشد. برای دو ماه اول، ریفامپیسین، ایزونیازید، پیرازینامید و اتامبوتول تجویز شود. در چهار ماه بعد، تنها ریفامپیسین و ایزونیازید تجویز شود.[۶] در صورتی که مقاومت به ایزونیازید بالا باشد، میتوان به جای آن از اتامبوتول در چهار ماه پایانی استفاده کرد.[۶]
بیماری عود کننده
اگر سل عود کند، قبل از شروع درمان برای تعیین آنتی بیوتیکهایی که به آن حساس است آزمایش انجام دهید.[۶] اگر سل مقاوم به چند دارو (MDR-TB) تشخیص داده شود، درمان با حداقل چهار آنتی بیوتیک مؤثر برای ۱۸-۲۴ ماه توصیه میشود.[۶]
مقاومت به دارو
مقاومت اولیه هنگامی رخ میدهد که فرد به یک گونه مقاوم سل مبتلا میشود. فرد مبتلا به سل کاملاً حساس (مستعد) ممکن است در طول درمان دچار مقاومت ثانویه (اکتسابی) شود. یک فرد در صورتی که از رژیم تجویز شده به طور مناسب پیروی نکند (عدم تطابق)، یا اگر از داروهایی با کیفیت پایین استفاده کند، ممکن است به دلیل درمان نامناسب دچار مقاومت ثانویه شود.[۷۶] سل مقاوم در برابر دارو، یک مسئله جدی در بهداشت عمومی بسیاری از کشورهای در حال توسعه است. درمان سل مقاوم در برابر دارو طولانی تر است و به داروهای گران تر نیاز دارد. MDR-TB به عنوان مقاومت در برابر دو داروی مؤثر رده اول سل: ریفامپیسین و ایزونیازید، تعریف شده است. سل بسیار مقاوم در برابر دارو در برابر سه یا بیشتر از سه مورد از شش کلاس داروهای رده دوم مقاوم است.[۷۷] سل کاملاً مقاوم در برابر دارو نسبت به تمام داروهایی که در حال حاضر استفاده میشود مقاوم است. سل کاملاً مقاوم در برابر دارو برای اولین بار در سال ۲۰۰۳ در ایتالیا مشاهده شد، اما از آن به بعد تا سال ۲۰۱۲ به طور گسترده گزارش نشده است.[۷۸]
پیش شناخت
پیشرفت عفونت سل به بیماری سل آشکار زمانی رخ میدهد که باسیل بر دفاعهای سیستم ایمنی غلبه و شروع به تکثیر کند. در بیماری سل اولیه (حدود ۱-۵٪ از موارد)، این پیشرفت به سرعت پس از عفونت اولیه رخ میدهد.[۱] با این حال، در اکثر موارد، یک عفونت نهفته بدون هیچ نشانه آشکاری رخ میدهد.[۱] این باسیلهای خفته باعث ایجاد سل فعال در ۵-۱۰٪ از این موارد نهفته میشوند، و اغلب این امر سالها پس از عفونت اتفاق میافتد.[۸]
خطر فعال شدن مجدد با سرکوب سیستم ایمنی افزایش مییابد، مانند آنچه که از آلودگی به HIV ناشی میشود. در افراد مبتلا به «M. tuberculosis» و HIV، خطر فعال شدن مجدد به ۱۰٪ در سال افزایش مییابد.[۱] مطالعاتی که از طرحهای DNA نژادهای «M. tuberculosis» استفاده میکنند، نشان میدهند که عفونت مجدد باعث عود سل بیشتر از آنچه قبلاً تصور میشد میشود.[۷۹] عفونت مجدد ممکن است موجب بیش از ۵۰٪ از موارد فعال شده مجدد در مناطقی که در آن سل شایع است بشود.[۸۰] احتمال مرگ و میر ناشی از سل در حدود ۴٪ در سال ۲۰۰۸ بود، که کمتر از ۸٪ در سال ۱۹۹۵ است.
شیوع
حدود یک سوم از جمعیت جهان با «M. tuberculosis» آلوده شده است. در هر ثانیه یک عفونت جدید در مقیاس جهانی رخ میدهد.[۳] با این حال، بسیاری از عفونتها به «M. tuberculosis» منجر به بیماریهای سل نمیشود،[۸۲] و ۹۰-۹۵٪ از عفونتها بدون علامت باقی میمانند.[۴۲] در سال ۲۰۰۷، حدود ۱۳٫۷ میلیون مورد مزمن فعال وجود داشت.[۴] در سال ۲۰۱۰، ۸٫۸ میلیون مورد جدید سل، و ۱٫۴۵ میلیون مرگ و میر شناسایی شد، که بیشتر اینها در کشورهای در حال توسعه اتفاق میافتد.[۵] از این ۱٫۴۵ میلیون مرگ و میر، در حدود ۰٫۳۵ میلیون نفر در افراد آلوده به HIV رخ داد.[۸۳]
سل دومین علت شایع مرگ ناشی از بیماریهای عفونی (پس از مرگ به علت HIV/AIDS) است.[۹] تعداد مطلق موارد ابتلا به سل («شیوع») از سال ۲۰۰۵ رو به کاهش بوده است. موارد جدید سل («بروز») از سال ۲۰۰۲ کاهش یافته است.[۵] چین به خصوص پیشرفت چشمگیری داشته است. چین میزان مرگ و میر ناشی از سل خود را بین سالهای ۱۹۹۰ و ۲۰۱۰ حدود ۸۰٪ کاهش داده است.[۸۳] سل در کشورهای در حال توسعه شایع تر است. حدود ۸۰٪ از جمعیت بسیاری از کشورهای آسیایی و آفریقایی در آزمون توبرکولین تست مثبت داشتهاند، اما تنها ۵-۱۰٪ از جمعیت ایالات متحده آزمون مثبت داشتهاند.[۱] کارشناسان امیدوار بودند که سل را به طور کامل کنترل کنند. با این حال، عوامل متعددی کنترل کامل سل را بعید میکند. تهیه یک واکسن مؤثر دشوار بوده است. تشخیص بیماری گران است و زمان زیادی میبرد. درمان چندین ماه طول میکشد. افراد مبتلا به HIV بیشتری گرفتار سل میشوند. سل مقاوم در برابر دارو در دهه ۸۰ مشاهده شد.[۶]
در سال ۲۰۰۷، کشور دارای بیشترین میزان شیوع تخمینی سل، سوازیلند، با ۱٬۲۰۰ مورد در هر ۱۰۰٬۰۰۰ نفر بود. هند بیشترین شیوع در کل را با ۲٫۰ میلیون مورد جدید داشت.[۴] در کشورهای توسعه یافته، سل کمتر شایع است و به طور عمده در مناطق برون شهری یافت میشود. در سال ۲۰۱۰، نرخ TB در هر ۱۰۰٬۰۰۰ نفر در مناطق مختلف جهان بدین شرح بود: در سطح جهانی ۱۷۸، آفریقا ۳۳۲، آمریکا ۳۶، شرق مدیترانه ۱۷۳، اروپا ۶۳، جنوب شرق آسیا ۲۷۸، و غرب اقیانوس آرام ۱۳۹.[۸۳] در کانادا و استرالیا، سل در میان مردم بومی بسیار رایج است، به ویژه در مناطق دور افتاده.[۸۵][۸۶] در ایالات متحده، مرگ و میر ناشی از سل سکنه بومی پنج برابر بیشتر است.[۸۷]
شیوع سل در سنین مختلف متفاوت است. در آفریقا، سل به طور عمده افراد بین ۱۲ و ۱۸ سال و نوجوانان را تحت تأثیر قرار میدهد.[۸۸] با این حال، در کشورهایی که در آن نرخ بروز سل به طور چشمگیری کاهش یافته است (مانند ایالات متحده)، سل عمدتاً بیماری افراد پیر و افراد دارای سیستم ایمنی در معرض خطر است.[۱][۸۹]
تاریخچه
سل از دوران باستان همراه انسان بوده است.[۶] قدیمی ترین تشخیص بدون ابهام «M. tuberculosis» شامل شواهد این بیماری در بقایای گاومیش کوهان دار امریکایی است که به ۱۷٬۰۰۰ سال پیش باز میگردد.[۹۰] با این حال، مشخص نیست که آیا سل، در گاومیش به وجود آمده و پس از آن به انسان منتقل شده است، یا اینکه از یک جد مشترک انشعاب یافته است.[۹۱] دانشمندان زمانی اعتقاد داشتند که انسان MTBC را از حیوانات هنگام اهلی کردن آنها گرفته است. با این حال، ژنهای مجموعه «M. tuberculosis» (MTBC) در انسان با MTBC در حیوانات مقایسه شدهاند، و ثابت شده است که این تئوری نادرست است. هر دو گونه باکتری سل یک جد مشترک دارند، که میتوانسته است انسان را در اوایل انقلاب نوسنگی آلوده کرده باشد.[۹۲] باقیماندههای اسکلتی نشان میدهد که انسانهای ماقبل تاریخ (۴۰۰۰ سال قبل از میلاد مسیح) سل داشتهاند. پژوهشگران پوسیدگی مسلول را در ستون فقرات مومیایی مصری یافتهاند که به ۳۰۰۰-۲۴۰۰ سال قبل از میلاد باز میگردد.[۹۳] «Phthisis» یک کلمه یونانی به معنی «مصرف» است که اصطلاح قدیمی برای بیماری سل ریوی میباشد.[۹۴] در حدود ۴۶۰ سال قبل از میلاد، بقراط سل ریوی را به عنوان گسترده ترین بیماری در آن زمان شناسایی کرد. افراد مبتلا به سل ریوی تب و سرفه خونین داشتند. سل ریوی تقریباً همیشه کشنده بود.[۹۵] مطالعات ژنتیکی نشان میدهد که سل از حدود سال ۱۰۰ میلادی در میان آمریکاییها وجود داشته است.[۹۶]
قبل از انقلاب صنعتی، فرهنگ عامه اغلب سل را با خون آشامها مرتبط می دانسته است. هنگامی که یکی از اعضای خانواده به دلیل سل فوت میکرد، دیگر اعضای آلوده، سلامت خود را به آرامی از دست میدادند. مردم بر این باور بودند که فرد اصلی مبتلا به سل زندگی را از دیگر اعضای خانواده می ربوده است.[۹۷]
نوع ریوی مرتبط با برآمدگیها به عنوان یک آسیب شناسی توسط دکتر ریچارد مورتون در سال ۱۶۸۹ تعیین شد.[۹۸][۹۹]با این حال، سل انواع مختلفی از علائم را داراست، از این رو، سل تا دهه ۲۰ قرن نوزدهم به عنوان یک بیماری واحد شناسایی نشده بود. این بیماری در سال ۱۸۳۹ توسط جی. ال. شوئن سل نامیده شد.[۱۰۰] طی سالهای ۱۸۳۸-۱۸۴۵، دکتر جان کروگان (John Croghan)، صاحب غار ماموت، افراد مبتلا به سل را به داخل غار میبرد به این امید که این بیماری را با درجه حرارت ثابت و خلوص هوای غار درمان کند: آنها ظرف یک سال درگذشتند.[۱۰۱] هرمان برمر (Hermann Brehmer) اولین آسایشگاه سل را در سال ۱۸۵۹ در Sokołowsko، لهستان باز کرد.[۱۰۲]
باسیلی که باعث بیماری سل میشود، «میکوباکتریوم توبرکلوسیس»، در ۲۴ مارس ۱۸۸۲ توسط رابرت کخ (Robert Koch) شناخته و توصیف شد. او موفق به دریافت جایزه نوبل در فیزیولوژی یا پزشکی در سال ۱۹۰۵ برای این کشف شد.[۱۰۳] کخ (Koch) معتقد نبود که بیماری سل گاومیشی (گاوی) و سل انسانی مشابه باشند. این باور درک اینکه که شیر آلوده هم یک منبع عفونت بود را به تعویق انداخت. پس از آن، خطر انتقال از این منبع با اختراع روند پاستوریزاسیون به طور قابل توجهی کاهش یافت. کخ (Koch) در سال ۱۸۹۰ یک عصاره گلیسیرین از باسیل سل را به عنوان «درمان» سل اعلام کرد. او آن را «توبرکولین» نامید. اگرچه «توبرکولین» مؤثر نبود اما از آن به عنوان یک تست غربالگری برای وجود سل پیش بالینی استفاده شد.[۱۰۴]
آلبرت کالمیت (Albert Calmette) و کامیل گوئرین (Camille Guérin) در سال ۱۹۰۶ اولین موفقیت را در ایمن سازی علیه سل به دست آوردند. آنها از گونه ضعیف شده سل گاوی استفاده کردند، و آن واکسن را BCG نامیدند (باسیل کلمنت و گوئرین). واکسن BCG برای اولین بار در سال ۱۹۲۱ در فرانسه بر روی انسانها مورد استفاده قرار گرفت.[۱۰۵] با این حال این واکسن BCG پس از جنگ جهانی دوم تنها در USA بریتانیا، و آلمان به صورت گسترده پذیرفته شد.[۱۰۶]
سل به عنوان گسترده ترین بیماری همه گیر فقرای شهری، باعث بزرگترین نگرانی عمومی در قرن ۱۹ و اوایل قرن ۲۰ شد. در سال ۱۸۱۵، یکی از هر چهار مرگ در انگلستان به دلیل «مصرف» بود. در سال ۱۹۱۸، سل دلیل یکی از هر شش مرگ در فرانسه بود. پس از اینکه دانشمندان دهه ۸۰ قرن ۱۹ فهمیدند که بیماری مسری است، سل در فهرست بیماریهای قابل اخطار رسمی در بریتانیا قرار گرفت. کمپینهایی برای جلوگیری از تف کردن مردم در مکانهای عمومی شروع شد و فقرای آلوده به رفتن آسایشگاههایی «تشویق» میشدند که شبیه زندان بود. (آسایشگاهها برای طبقات متوسط و بالا، مراقبتهای عالی و مراقبتهای پزشکی ثابت ارائه میکردند.)[۱۰۲] آسایشگاه ظاهراً مزایای «هوای تازه» و کار ارائه میکردند. اما حتی تحت بهترین شرایط، ۵۰٪ از افرادی که وارد آنجا میشدند ظرف پنج سال فوت میکردند (“ca. ” ۱۹۱۶)[۱۰۲]
نرخ سل در اروپا، در اوایل قرن ۱۷ شروع به افزایش کرد. سل در اروپا در قرن ۱۸ به اوج خود رسید، زمانی که عامل نزدیک به ۲۵٪ از تمام مرگ و میرها بود.[۱۰۷] مرگ و میر پس از آن در دهه ۵۰ قرن بیستم نزدیک به ۹۰٪ کاهش یافت.[۱۰۸] بهبود سلامت عمومی به طور قابل توجهی میزان سل را حتی قبل از استفاده از استرپتومایسین و آنتی بیوتیکهای دیگر کاهش داد. با این حال، این بیماری یک تهدید قابل توجه برای بهداشت عمومی باقیماند. هنگامی که شورای تحقیقات پزشکی در انگلستان در سال ۱۹۱۳ تشکیل شد، تمرکز اولیه آن تحقیقات سل بود.[۱۰۹]
در سال ۱۹۴۶، تولید آنتی بیوتیک استرپتومایسین درمان مؤثر و درمان سل را به یک واقعیت تبدیل کرد. قبل از اینکه این دارو معرفی شود، تنها درمان (به جز آسایشگاهها) مداخله جراحی بود. «روش پنوموتوراکس» ریه آلوده را کلاپس و بیحرکت میکرد تا به آن «استراحت» دهد و امکان درمان ضایعات سلی را فراهم نماید.[۱۱۰] پیدایش MDR-TB، دوباره جراحی را به عنوان گزینهای از استانداردهای قابل قبول مراقبت در درمان عفونت سل معرفی کرد. مداخلات جراحی کنونی شامل حذف پاتولوژیک حفرههای قفسه سینه («تاول») در ریهها برای کاهش تعداد باکتریها و برای افزایش در معرض دارو قرار گرفتن باکتریهای باقیمانده در جریان خون میباشد. این مداخله به طور همزمان بار باکتریایی را کاهش میدهد و باعث افزایش اثربخشی درمان آنتی بیوتیک سیستمیک میشود.[۱۱۱] اگرچه کارشناسان امیدوار بودند سل را به طور کامل حذف کنند (آبله)، پیدایش گونههای مقاوم در برابر دارو در دهه ۸۰ قرن بیستم حذف سل را غیر محتمل تر کرد. تجدید حیات متعاقب سل موجب اعلام یک وضعیت اضطراری برای بهداشت جهانی توسط WHO در سال ۱۹۹۳ شد.[۱۱۲]
جامعه و فرهنگ
سازمان بهداشت جهانی و بنیاد بیل و ملیندا گیتس (Bill and Melinda Gates) در حال ارائه کمکهای مالی به تهیه یک آزمون تشخیصی سریع برای استفاده در کشورهایی با درآمد پایین و متوسط هستند.[۱۱۳][۱۱۴] در سال ۲۰۱۱، بسیاری از مکانهای فقیر هنوز هم تنها به میکروسکوپی خلط دسترسی دارند.[۱۱۵]
در سال ۲۰۱۰، هند بالاترین تعداد کل موارد ابتلا به سل در سراسر جهان را داشت. یکی از دلایل، مدیریت ضعیف این بیماری توسط بخش مراقبتهای بهداشتی خصوصی بود. برنامههایی مانند برنامه کنترل سل ملی اصلاح شده به کاهش میزان سل در میان افرادی که مراقبتهای بهداشتی عمومی دریافت میکنند، کمک میکند.[۱۱۶][۱۱۷]
تحقیقات
واکسن BCG دارای محدودیتهایی است، و تحقیق برای تهیه واکسن سل جدید در حال انجام است.[۱۱۸] چند کاندیدای احتمالی در حال حاضر در فاز I و II کارآزمایی بالینی هستند.[۱۱۸] دو رویکرد اصلی در حال تلاش برای بهبود اثر بخشی واکسن موجود هستند. یک رویکرد شامل اضافه کردن یک واکسن زیرواحد به BCG است. استراتژی دیگر در تلاش برای ایجاد واکسنهای جدید و بهتر است.[۱۱۸] MVA85A نمونهای از یک واکسن زیرواحد است که در حال حاضر در آفریقای جنوبی در دست آزمایش میباشد. MVA85A مبتنی بر یک ویروس آبله گاوی با اصلاح ژنتیک میباشد.[۱۱۹] امید است که واکسنها نقش مهمی را در درمان بیماری نهفته و فعال داشته باشند.[۱۲۰]
برای تشویق کشف بیشتر، محققان و سیاست گذاران، مدلهای جدید اقتصادی توسعه واکسن را ترویج میدهند، از جمله جوایز، مشوقهای مالیاتی، و تعهدات بازار پیشرفته.[۱۲۱][۱۲۲] گروههای متعددی در تحقیقات شرکت دارند، از جمله مشارکت توقف سل،[۱۲۳] ابتکار واکسن سل در آفریقای جنوبی، و بنیاد جهانی واکسن سل Aeras.[۱۲۴] بنیاد جهانی واکسن سل Aeras هدیهای به مبلغ بیش از ۲۸۰ میلیون دلار (امریکا) را از بنیاد بیل و ملیندا گیتس به منظور توسعه و تجویز یک واکسن بهبود یافته علیه سل برای استفاده در کشورهای دارای سرایت بالای سل دریافت کرد.[۱۲۵][۱۲۶]
در سایر حیوانات
میکوباکتریها بسیاری از حیوانات مختلف را آلوده میکنند، از جمله پرندگان،[۱۲۷]جوندگان،[۱۲۸] و خزندگان.[۱۲۹] زیرگونه «Mycobacterium tuberculosis» به ندرت در حیوانات وحشی دیده میشود.[۱۳۰] تلاش برای ریشه کنی سل گاوی ناشی از «میکوباکتریوم بوویس» از گلههای گاو و گوزن نیوزیلند نسبتاً موفق بوده است.[۱۳۱] تلاشها در بریتانیا کمتر موفق بودهاند.[۱۳۲][۱۳۳]
حصبه
حَصْبه (نامهای دیگر:[۱] تب روده، تب تیفوئید، مطبقه) یک بیماری عفونی است، که در اثر باکتری سالمونلا تیفی (انگلیسی: Salemonella Typhi) ایجاد میشود، این بیماری واگیردار بوده و از طریق آب و غذای آلوده گسترش مییابد و معمولاً با تب بالا، اسهال، بیاشتهایی و سردرد بروز میکند.
میکروب حصبه در آبهای گل آلود تا یکماه و در یخ تا ۳ ماه زنده میماند، در اثر گرمای ۶۰ تا ۱۰۰ درجه از میان میرود و بخصوص نور آفتاب به سرعت سبب انهدام میکروب میشود. در برابر خشکی هم تا دو ماه مقاومت دارد.
حصبه ممکن است به شکل تکگیر یا همهگیر درآید در فصل پائیز و تابستان بیشتر بصورت همه گیر در میآید، این همه گیری بخصوص در اجتماعات مانند سربازخانهها و مدارس دیده میشود. این بیماری در کشور ما در تمام فصول فراوان است ولی در تابستان و پائیز بیشتر است.
در زمان جنگ که تمام این شرایط موجود است شیوع این بیماری چشمگیر است. افراد تازهوارد که به مناطق آلوده وارد میشوند بیشتر از افراد بومی مبتلا میگردند، کم شدن ترشح اسید معده هم در آلودگی مؤثر است زیرا اسید معده خاصیت میکروبکشی دارد.
محتویات
همهگیرشناسی
طبق آمار سازمان بهداشت جهانی در سال ۲۰۰۷، تعداد افراد مبتلا به تب تیفوئید بین ۱۶ تا ۳۳ میلیون نفر میباشد، و سالانه بین ۵۰۰٬۰۰۰ تا ۶۰۰٬۰۰۰ تن از این بیماری تلف میشوند.
انتقال این بیماری از طریق جذب غذا یا آب آلوده به مدفوع فردی بیمار یا سالم ولی ناقل صورت میگیرد. تب تیفوئید در کشورهای پیشرفته بسیار نادر است. شیوع آن در آسیای جنوب شرقی، آسیای مرکزی و جنوب آفریقا بیشتر است.
راههای سرایت بیماری
میکروب بیماری تیفوئید از راه دهان وارد دستگاه گوارش شده و از آنجا به سایر نقاط بدن میرسد و نشانههای بیماری را پدیدار میسازد، میکروب باسیل از راه مدفوع به خارج راه مییابد مدفوع و صفرا در دوران استقرار بیماری آلوده میباشند. گاهی در ادرار و استفراغ بیماران نیز باسیل وجود دارد. بیشتر بیماران در دوران نقاهت هم عامل انتشار میکروب بشمار میروند.
- سرایت مستقیم: پرستاران و مراقبان بیماران از راه دستهای خود آلوده میگردند. آنهائی که لگن بیمار را برمیدارند و یا لباس و ملحفههای وی را عوض میکنند و در معرض آلودگی مستقیم قرار دارند؛ بنابراین اگر کمال نظافت بعد از تماس با مریض رعایت شود آلودگی ناچیز خواهد شد. برخی از پزشکان حصبه را بیماری دستهای کثیف نامیدهاند.
- سرایت غیرمستقیم: آب - بهترین منبع آلودگی را تشکیل میدهد و این مطلب درآلودگیهای لولههای آب یک محله یا یک قنات و آلوده کردن تعداد زیادی از افراد با ثبات میرسد، گذشته از آب، مواد غذائی، شیر و سبزیجات و نرم تنان دریایی (صدفهاو میگوو...) نیز ممکن است توسط آب آلوده گردند.
- پیش از این یخ غیربهداشتی یک عامل انتقال بیماری در ایران بهشمار میرفت.
- آلودگی شیر، پنیر تازه توسط آب آلوده یا دستهای آلوده دیده شدهاست.
- سبزیجات، سبزیجاتی را که با کود انسانی میکارند احتمال آلودگی آن زیاد است.
- نرمتنان دریائی و صدفها و میگو غیره یکی از منابع آلودگی در کشورهای اروپایی بهشمار میآیند. صدفهائی که در مسیر پساب و رودخانههای کثیف قرار میگیرند آلوده میشوند.
- مگس هم عامل مهمی در پخش بیماری است.
- در آزمایشگاهها افرادی که با کشت و مطالعات این میکروبها سروکار دارند ممکن است تصادفاً آلوده گردند، پزشکان بخشهای عفونی هم بدلایل بالا بیشتر در معرض آلودگی میباشند.
- پودر گوشت، تخم مرغ و سایر مواد غذائی هم ممکن است عامل سرایت بیماری باشند.
نشانههای ابتلا
بیماری به آرامی شروع میشود: تب مختصر، خستگی، سرگیجه، کوفتگی، خواب مختل، دهان تلخ و یبوست. بتدریج این علائم شدت مییابد، بعلاوه سردرد شدید، درد پیشانی بوجود میآید، درد کمر و گردن و بیحالی عارض میشود، شکم نفخ پیدا کرده کمی دردناک میشود مخصوصاً در پهلوی راست و پائین شکم درد محسوس میباشد یا بجای یبوست اسهال فرا میرسد.
طحال بزرگ میشود گاهی خون دماغ وجود دارد. بسیاری از بیماران در چند روز اول بیماری سرفه کرده و نشانههای یک برونشیت حاد را دارند. صبحها تب کم بوده و شبها بالا میرود تا اینکه در ظرف ۴ تا ۵ روز تب به ۴۱ درجه میرسد، نبض نسبت به تب کندتر میباشد.
۵ تا ۸ روز علائم شدت مییابد یعنی استقرار بیماری فرا میرسد بیمار در رختخواب خود بیحرکت میافتد و نسبت به اطرافیان بی اعتنا میباشد و یا اینکه در بیحالی و کوفتگی عمیقی غوطه ور میباشد گاهی هذیان و بی خوابی وجود دارد، بیمار اشیاء مبهمی را در هوا جستجو میکند، عطش زیاد دارد لبها و زبان خشک است، اشتها کم است نفخ شکم زیاد و در لمس پهلوی راست و پائین شکم درد وجود دارد. در حصبه سخت، اسهال آبکی وجود دارد. تب دائماً در ۴۰ درجه سانتیگراد باقیمانده، صبح و شب کمی با هم اختلاف دارد یعنی صبحها کمتر و شبها زیادتر است.
مشخصات بیماری
پس از آن که باکتریهای سالمونلا تیفی وارد دستگاه گوارش شدند، دیوارهٔ روده را سوراخ میکنند، و آنگاه، توسط ماکروفاژها بلعیده میشوند (فاگوسیتوز). در این میان، ساختار این باکتریها جهش یافته و دربرابر آنزیمهای ماکروفاژها مقاومت پیدا میکنند. به این ترتیب، این باکتریها درون ماکروفاژها باقی میمانند و توسط دستگاه لنفاوی درون ماکروفاژها تکثیر یافته و در سیستم رتیکولوآندوتلیال (شامل غدد لنفاوی و سلولهای طحال و کبد)، و سپس در سراسر بدن پخش میشوند.
دورهٔ نهفتگی آن حدود یک هفتهاست. روند بیماری تب تیفوئید به طور معمول به ۴ دوره تقسیم میشود که هر کدام از آنها حدود یک هفته طول میکشد. در هفتهٔ اول بیماری دمای بدن فرد اندکی افزایش پیدا میکند، و او دچار سردرد، برادی کاردی نسبی (نامناسب با تب)، و در برخی موارد خونریزی بینی و درد شکم میشود. در این مدت تعداد گلبولهای سفید خون وی کاهش مییابند. سپتیسمی (ورود باکتری به خون) در این مرحله رخ میدهد.
در هفتهٔ دوم بیماری، فرد دچار تبی حدود ۴۰ درجه سانتیگراد، همراه با تعرق ولی بدون افزایش تعداد نبض میشود. این تب میتواند موجب هذیان نیز شود. در برخی از بیماران (حدود یکسوم آنان)، کهیرهایی قرمزرنگ بر روی پوست شکم یا قفسهٔ سینه ظاهر میشوند. درد یا ورم شکم، اسهال (و در برخی افراد یبوست) و بزرگ شدن طحال (اسپلنومگالی) از دیگر علایم این دوره هستند.
در هفتهٔ سوم، تب همچنان بالا میماند، و فرد میتواند دچار خونریزی در روده شود. از بین بردن باکتریهای سالمونلا تیفی موجب آزاد شدن اندوتوکسین آنها میشود. این ماده گاهی موجب سوراخ شدن دیوارههای روده و خونریزی و در مواردی پری تونیت و حتی سپتی سمی شده، که موارد فوق میتوانند مرگآور باشند (احتمال آن حدود ۳۰٪ میباشد). خستگی و اغتشاش ذهنی از دیگر علایم این دوره میباشند. مواردی از کوله سیستیت، آبسههای متاستاتیک، و انسفالیت نیز در این فاز دیده شدهاند. احتمال تب در روزهای آخر هفته قدری کاهش میبابد.
در مرحلهٔ چهارم، تب به آهستگی کاهش مییابد، و سایر علایم بیماری ناپدید میشوند.
عوارض حصبه
بسیار متعدد است - خونریزی روده، سوراخ شدن رودهها، ورم آپاندیس، ورم کیسه صفرا، یرقان، ورم غده بناگوشی عوارض دیگر از قبیل نارسائی قلبی، عارضه استخوانی، تنفسی، ادراری، پوستی، ورم بیضه، مننژیت، آماس کلیهها (پیلونفریت) و پستانها و تورم مفصلی ملاحظه میشود.
تشخیص آزمایشگاهی
آزمایشهائی که از نظر تشخیص تیفوئید مورد استفاده قرار میگیرد بترتیب اهمیت عبارتند از: کشت خون، کشت ادرار و خلط، کشت مغز استخوان و آزمایشهای سرمی (ویدال فلیکس)؛ کشت مدفوع (در کشور ما که بیماری بومی است کشت مثبت مدفوع را باید با آزمایشات دیگر تکمیل کرد).
جلوگیری و درمان
تشخیص این بیماری معمولاً از طریق آزمایش ویدال انجام میگیرد که آزمایش فوق در صورت وجود آنتی بادی ضد آنتی ژنهای سطحی (آنتی ژن O) یا آنتی ژنهای فلاژل (آنتی ژن H) مثبت میشود.
درمان تب تیفویید پس از کنترل عوارض بیماری و پایدار شدن علائم حیاتی با استفاده از آنتیبیوتیک (قبلاً کلرامفنیکل و امروزه فلوئوروکوئینولون یا سفتریاکسون) صورت میگیرد. از اقداماتی که به منظور پیشگیری بیماری انجام میگیرند میتوان رعایت بهداشت فردی و عمومی را نام برد. عدم آشامیدن آبهای ناسالم در مناطقی که بیماری در آن شایع است یکی دیگر از راههای پیشگیری میباشد.
به علاوه، واکسن تب تیفوئید نیز در جلوگیری از ابتلا به آن مفید است.
درمان
- رژیم غذائی و الکترولیت: باید به بیماران مقادیر کافی مایع رسانده شود و برای این منظور تشویق بیماران به نوشیدن مایعات زیاد لازم است. توجه به تعادل آب و الکترولیت هنوز مهمترین و فوریترین اقدام است.
- درمان با آنتی بیوتیکها با توصیه پزشک که معمولاً کینولونها یا سفالوسپورینها هستند.
پیشگیری
تیفوئید حاد بصورت همه گیر و تک گیر بروز میکند و بیشتر اوقات مسئول آنها ناقلان سالم یا بیماران میباشند. این بیماری مخصوص انسان است و دو نوع پیشگیری را ایجاب میکند: ۱ - پیش گیری دسته جمعی ۲ - پیش گیری انفرادی
در پیش گیری دسته جمعی میباید بیماران و حاملان سالم را مشخص کرده و آنها را معالجه نمود و خاستگاه سرایت را از بین برد.
در پیش گیری انفرادی باید افرادیکه در معرض آلودگی به بیماری هستند ایمنی بخشید و آنهم بوسیله واکسیناسیون امکانپذیر است؛ ولی باید دانست که هر دو این وسائل برای جلوگیری از تیفوئید ضرورت دارند و یکی بدون دیگری امکانپذیر نیست.
پیشگیری دسته جمعی: در پیش گیری دسته جمعی پزشک معالج و اداره بهداشت وظیفه عمدهای دارند: پزشک معالج باید هر چه زودتر بیماری را تشخیص داده و نوع آن را بمراکز بهداری گزارش دهد، بعلاوه در جریان ناخوشی به اطرافیان مریض طرز سرایت وگندزدائی ادرار و مدفوع را بیاموزد. همچنین ملحفه و لباس زیر و یا وسائل دیگر آلوده بیمار را بهتر است با آب ژاول و جوشاندن و بخار آب و غیره گندزدایی کنیم، بعد از بهبود بیماری میباید گندزدائی نهائی انجام شود. در صورت امکان بهتر است پزشک معالج خاستگاه سرایت را جستجو کند. بعلاوه مراقبت و بازرسی دقیق مواد خوراکی، صدفها، شیر، آب، مشروبات غیرالکلی و غیره، این مواد را چه از نظر تهیه و توزیع و فروش باید تحت کنترل دقیق قرار داد، تهیه آب آشامیدنی و فاضلاب هم در پیشگیری بسیار مهم است. غدغن کردن کاربرد کود انسانی در سبزیکاری، از بین بردن مگس در نقاط آلوده و آموختن بهداشت عمومی بمردم ارکان پیشگیری دسته جمعی را تشکیل میدهد.
تومور
تومور (باریشه لاتین tumor) که به معنی هر نوع برآمدگی بدن میباشد[۱] نوعی نئوپلازی است. تومور در زبان عاميانه به اشتباه برابر با سرطان دانسته میشود در حالیکه سرطان خود نوعی تومور و همیشه بدخیم است ولی تومور میتواند ماهیت خوشخیم و یا بدخیم داشته باشد.
محتویات
ماهیت تومور
- خوش خیم: کشنده نیست و به سایر نواحی بدن دست اندازی (invasion) ندارد.
- بدخیم: کشنده است و در مراحل رشد خود به سایر نواحی بدن دست اندازی می کند. دست اندازی تومورها بسته به ماهیت شان می تواند تهاجم مستقیم نسج تومور به بافت های مجاور با نام اینفیلتراسیون (درگیری اولیه) ویا از طریق خون یا لنف با نام متاستازی (درگیری ثانویه) باشد.
| مشخصه | تومور بدخیم | تومور خوشخیم |
|---|---|---|
| کپسولدار بودن | بهندرت | اغلب |
| تمایز یافتگی | اندک | تاحدودی |
| متاستاز | غالباً | ندارد |
| عود | مکرر | بهندرت |
| عروق | متوسط تا زیاد | اندک |
| مشخصات سلولی | غیرطبیعی و بی شباهت به سلول والد | نسبتاً طبیعی و مشابه سلول والد |
علل ایجاد تومور
به طور کلی دو دسته تومور وجود دارد.
- نئوپلاستیک: بیشتر (و نه همه) نئوپلاسمها تومورساز هستند.
- غیر نئوپلاستیک:
برخی تومورهای مشهور
ایدز
-
ایدز (به انگلیسی: AIDS) یا سندرم نقص ایمنی اکتسابی (به انگلیسی: Acquired immune deficiency syndrome)، نوعی بیماری است که در دستگاه ایمنی و توسط ویروس نقص ایمنی (HIV) ایجاد میشود.[۱] بیماری ناشی از ویروس HIV دارای سه مرحله اصلی است. در مرحله اول (عفونت حاد) فرد ممکن است برای مدت کوتاهی بیماری شبه آنفلوآنزایی را تجربه کند. به همین دلیل معمولاً این بیماری تا یک دوره طولانی بدون هیچ علائمی دنبال میشود که به این مرحله از بیماری، دوره نهفتگی گفته میشود. هر چقدر که بیماری پیشرفت یابد، تداخل بیشتری با دستگاه ایمنی بدن پیدا میکند و باعث میشود که افراد به عفونتهایی مانند عفونت فرصتطلب و تومور دچار شوند، البته معمولاً در افرادی که دستگاه ایمنی آنها به خوبی عمل میکند تاثیرگذار نیست. در نهایت بیماری زمانی وارد مرحله سوم یا ایدز خواهد شد که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد.
HIV عمدتاً از طریق آمیزش جنسی (از جمله مقعدی و حتی دهانی) محافظت نشده، انتقال خون آلوده و سرسوزن آلوده و از مادر به فرزند در طول بارداری، زایمان یا شیردهی منتقل میگردد.[۲] بعضی از مایعات بدن مانند بزاق و اشک قادر به انتقال HIV نیستند.[۳] پیشگیری از عفونت HIV، عمدتاً از طریق آمیزش جنسی امن و برنامه تعویض سرنگ، راه حلی برای جلوگیری از گسترش این بیماری محسوب میشوند. هیچگونه درمان یا واکسن وجود ندارد؛ اگر چه درمان ضدویروسی میتواند باعث کاهش دوره بیماری و امید به زندگی نزدیک به طبیعی گردد. با وجود این که درمان ضدویروسی خطر مرگ و عوارض ناشی از این بیماری را کاهش میدهد، اما این داروها گرانقیمت هستند و ممکن است با عوارض جانبی همراه باشند.
پژوهشهای ژنتیکی نشان میدهند که HIV در اصل در اوایل قرن بیستم میلادی در غرب آفریقا جهش و پدید آمده است.[۴] ایدز اولین بار در سال ۱۹۸۱ توسط مرکز کنترل و پیشگیری بیماری (CDC) شناخته شد، در حالی که عامل آن (عفونت HIV) در اوایل آن دهه شناخته شده بود.[۵] از زمان کشف آن تا سال ۲۰۰۹، ایدز باعث مرگ ۳۰ میلیون نفر شده است.[۶] تا سال ۲۰۱۰، حدوداً ۳۴ میلیون نفر به ایدز مبتلا بودهاند.[۷] ایدز به عنوان همهگیری جهانی شناخته میشود که در حال حاضر حوزه شیوع آن بسیاره وسیع و در حال گسترش است.[۸]
ایدز تاثیر بسیار زیادی بر روی جوامع داشتهاست، چه به عنوان یک بیماری و چه به عنوان عاملی برای تبعیض. همچنین تاثیرات اقتصادی قابل توجهی داشته است. تصورهای نادرست بسیاری در رابطه با ایدز وجود دارد، برای مثال انتقال ایدز از طریق رابطههای سطحی غیرجنسی. این بیماری همچنین موضوع مجادله ادیان شده است.
محتویات
علائم و نشانهها
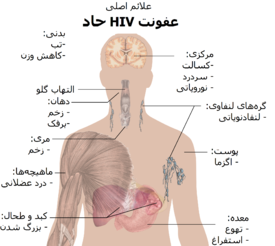
نوشتار اصلی: علائم و نشانههای اچآیوی/ایدزعفونت HIV دارای سه مرحله اصلی است: عفونت حاد، دوره نهفتگی و ایدز[۹][۱۰]
عفونت حاد
علائم اصلی عفونت حاد HIVدوره اولیه HIV، عفونت حاد HIV و یا سندرم حاد رتروویروسی نامیده میشود.[۹][۱۱] بسیاری از افراد ۲ تا ۴ هفته پس از در معرض قرار گرفتن این بیماری، دچار بیماریهایی مانند شبه-آنفلوآنزا یا شبه-مونونوکلئوز میشوند و برخی دیگر هم هیچ نشانه قابل توجهی در آنها دیده نمیشود.[۱۲][۱۳]علائم در ۴۰ تا ۹۰ درصد موارد رخ میدهد و معمولاً شامل تب، لنفادنوپاتی، فارنژیت، خارش پوست، سردرد و/یا زخم دهان و اندام تناسلی میشود.[۱۱][۱۳] خارش پوست که در ۲۰ تا ۵۰ درصد موارد رخ میدهد، خود را بر روی بالاتنه نشان میدهد و به شکل ماکولوپاپولر میباشد.[۱۴] همچنین در این مرحله برخی از افراد دچار عفونتهای فرصتطلب میشوند.[۱۱] ممکن است در دستگاه گوارش علائمی مانند تهوع، استفراغ و یا اسهال رخ دهد، و همچنین علائم عصبی نوروپاتی محیطی و یا سندرم گیلان باره.[۱۳] طول دوره این علائم متفاوت است، اما معمولاً یک یا دو هفته میباشد.[۱۳]
با توجه به اینکه این علائم آنچنان خاص نیستند، اغلب به عنوان نشانههایی از عفونت HIV شناخته نمیشوند. حتی مواردی که توسط یک دکتر خانوادگی و یا یک بیمارستان دیده میشود اغلب یا بسیاری از بیماریهای شایع عفونی با علائمی مشترک با آن اشتباه میشود. بنابراین شایسته است که عفونت HIV در بیمارانی که دارای عوامل مستعدکننده هستند، مد نظر باشد.[۱۳]
دوره نهفتگی
پس از علائم اولیه، بیمار وارد مرحلهای به نام دوره نهفتگی یا HIV بینشانه یا HIV مزمن میشود.[۱۰] این مرحله از HIV میتواند بدون هیچ گونه درمانی از حدود سه سال[۱۵] تا بیش از ۲۰ سال[۱۶] (به طور متوسط حدود هشت سال)[۱۷] به طول بینجامد. اگرچه معمولاً در ابتدای بیماری هیچ علائمی مشاهده نمیشود و یا علامتهای خیلی کمی دیده میشود، اما در نزدیکی پایان این مرحله بسیاری از افراد دچار تب، کاهش وزن، مشکلات گوارشی و دردهای عضلانی میشوند.[۱۰] همچنین ۵۰ تا ۷۰ درصد از افراد دچار لنفادنوپاتی ماندگار میشوند، بطوری که چند گروه از غدد لنفاوی (به جز در کشاله ران) به مدت بیش از سه تا شش ماه بدون هیچ درد و به طور توجیهناپذیری بزرگ میشود.[۹]
اگرچه بسیاری از مبتلایان HIV-1، قابل تشخیص هستند و در صورت عدم درمان نهایتاً به ایدز منجر خواهد شد، ولی درصد کمی از آنها (حدود ۵٪) سطح بالای سلولهای CD4+ T خود را بدون هیچ درمان ضدویروسی تا بیش از ۵ سال حفظ میکنند.[۱۳][۱۸] این افراد به عنوان کنترلکنندههای HIV طبقهبندی میشوند، و آنهایی که مقدار کم یا غیر قابل محسوسی از ویروس را بدون درمان ضدویروسی در بدن خود نگه میدارند به عنوان «کنترلکنندگان ممتاز» یا «سرکوبگران ممتاز» شناخته میشوند.[۱۸]
سندرم نقص ایمنی اکتسابی
علائم اصلی ایدزسندرم نقص ایمنی اکتسابی (ایدز) زمانی معنی پیدا میکند که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد و یا بیماریهای خاص مرتبط با عفونت HIV رخ دهد.[۱۳] در غیاب درمان، حدود نیمی از افراد مبتلا به HIV در عرض ده سال مبتلا به بیماری ایدز میشوند.[۱۳] رایجترین وضعیتهایی که هشداری بر وجود ایدز هستند پنومونی ناشی از پنوموسیستیس (۴۰٪)، نزاری به شکل سندرم اتلاف اچآیوی (۲۰٪) و کاندیدیاز مری میباشند. سایر علائم شایع شامل عفونتهای دستگاه تنفسی در یک دوره زمانی معین میشود.[۱۳]
عفونت فرصتطلب ممکن است توسط باکتری، ویروس، قارچ و انگل به وجود بیاید که معمولاً توسط دستگاه ایمنی بدن کنترل میشود.[۱۹] اینکه کدام عفونت رخ میدهد تا حدودی به این بستگی دارد چه عواملی در محیط اطراف فرد قرار دارد.[۱۳] این عفونت تقریباً میتواند هر دستگاهی از بدن را تحت تاثیر قرار دهد.[۲۰]
افراد مبتلا به ایدز خطر آلودگی به ویروسهای سرطانی مختلفی را دارند از جمله: سارکوم کاپوزی، لنفوم بورکیت، لنفوم اولیه دستگاه عصبی مرکزی، و سرطان گردن رحم.[۱۴] سارکوم کاپوزی، شایع ترین سرطانی است که در ۱۰ تا ۲۰ درصد از افراد مبتلا به HIV اتفاق میافتد.[۲۱] پس از آن لنفوم شایع ترین سرطان است و علت مرگ نزدیک به ۱۶ درصد از افراد مبتلا به ایدز میباشد و در ۳ تا ۴ درصد از موارد، اولین نشانه ایدز است. هر دوی این سرطانها با ویروس هرپس ۸ انسانی همراه هستند.[۲۱] خیلی اوقات مبتلایان به ایدز به دلیل ارتباطی که با ویروس پاپیلوم انسانی (HPV) دارد، دچار سرطان گردن رحم میشوند.[۲۱]
علاوه بر این، آنها به طور مکرر دچار علائمی مانند تب طولانی، تعریق شبانه، تورم غدد لنفاوی، لرز، ضعف، و کاهش وزن میشوند.[۲۲] اسهال یکی دیگر از علائم شایعی است که ۹۰٪ از افراد مبتلا به ایدز دچار آن میشوند.[۲۳]
راههای انتقال
میانگین احتمال انتقال HIV در هر عمل
بر اساس طریق انتقال از منبع سرایتطریق انتقال احتمال سرایت انتقال خون ۹۰%[۲۴] زایمان (فرزند) ۲۵%[۲۵] تزریق با سرنگ مشترک ۰.۶۷%[۲۴] فرو رفتن سرسوزن در بدن ۰.۳۰%[۲۶] رابطه جنسی مقعدی (دهنده)* ۰.۰۴–۳.۰%[۲۷] رابطه جنسی مقعدی (واردکننده)* ۰.۰۳%[۲۸] رابطه جنسی آلت-واژن (دهنده)* ۰.۰۵–۰.۳%[۲۷][۲۹] رابطه جنسی آلت-واژن (واردکننده)* ۰.۰۱–۰.۳۸%[۲۷][۲۹] رابطه جنسی دهانی (دهنده)*§ ۰–۰.۰۴%[۲۷] رابطه جنسی دهانی (واردکننده)*§ ۰–۰.۰۰۵%[۳۰] * با فرض عدم استفاده از کاندوم
§ منبع به رابطه جنسی دهانی
انجام شده روی یک مرد اشاره داردHIV از سه طریق اصلی انتقال مییابد:
- تماس جنسی
- قرار گرفتن در معرض خون و یا بافت آلوده
- از مادر به فرزند در دوران بارداری، زایمان، یا تغذیه با شیر مادر (که با نام انتقال عمودی شناخته میشود)[۲]
هیچ گونه خطر انتقال از طریق ویروس مدفوع، ترشحات بینی، بزاق، خلط، عرق، اشک، ادرار، یا استفراغ وجود ندارد مگر اینکه با خون آلوده شده باشند.[۲۶]
تماس جنسی
شایعترین حالت انتقال HIV از طریق تماس جنسی با فرد آلودهاست.[۲] اکثر موارد انتقال HIV در سراسر دنیا از طریق تماس با جنس مخالف رخ میدهد. با این حال، شکل انتقال در هر کشور متفاوت است.[۲] در ایالات متحده، از سال ۲۰۰۹، بیشتر انتقالهای جنسی در مردان همجنسگرا رخ داده است،[۲] که ۶۴٪ از تمام موارد مشاهده شده را شامل میشود.[۳۱]
در مورد تماس محافظت نشده با جنس مخالف، تخمین خطر انتقال HIV در هر عمل جنسی در کشورهای کم درآمد چهار تا ده برابر بیشتر نسبت به کشورهای با درآمد بالا است.[۳۲] در کشورهای با درآمد کم، خطر ابتلا از زن به مرد انتقال به ۰٫۳۸٪ در هر بار نزدیکی و از مرد به زن ۰٫۳۰٪ در هر بار نزدیکی تخمین زده شدهاست. این تخمین برای کشورهای با درآمد بالا، ۰٫۰۴٪ در هر بار نزدیکی برای انتقال از زن به مرد و ۰٫۰۸٪ در هر بار نزدیکی از مرد به زن میباشد.[۳۲] خطر انتقال از مقاربت مقعد بیشتر است، و ۱٫۴ تا ۱٫۷ درصد در هر بار نزدیکی با جنس مخالف یا موافق تخمین زده شدهاست.[۳۲] اگرچه خطر ابتلا از طریق آمیزش جنسی دهانی نسبتاً کم است، اما این احتمال وجود دارد.[۳۳] خطر انتقال از طریق رابطه دهانی «نزدیک به صفر» توصیف شده است،[۳۴] اگر چه چند موردی گزارش شدهاست.[۳۵] خطر ابتلا از طریق سکس دهانی صفر تا ۰٫۰۴ درصد تخمین زده شدهاست.[۳۶] در محیطهایی عمومی مانند روسپیها، خطر انتقال از زن به مرد ۲٫۴٪ در هر بار نزدیکی و از مرد به زن ۰٫۰۸ درصد در هر بار نزدیکی تخمین زده شدهاست.[۳۲]
خطر انتقال در حضور بیماریهای آمیزشی[۳۷] و زخم تناسلی[۳۲] افزایش مییابد. به نظر میرسد زخم تناسلی خطر ابتلا را تا حدود پنج برابر افزایش میدهد.[۳۲] بیماریهای مقاربتی دیگر مانند سوزاک، کلامیدیا، تریکومونا، و واژینوز باکتریال، به نسبت کمتری خطر انتقال را افزایش میدهند.[۳۶]
بار ویروسی از فرد آلوده نیز عامل مهمی است که در انتقال از طریق تماس جنسی (و همچنین از طریق مادر به فرزند) نقش دارد.[۳۸] در طول ۲٫۵ ماه اول از عفونت، میزان سرایت به دلیل بار زیاد ویروسی، ۱۲ برابر بیشتر است.[۳۶] در مراحل آخر عفونت فرد، میزان انتقال در حدود هشت برابر بیشتر است.[۳۲]
رابطه جنسی خشن میتواند یکی از عوامل موثر در افزایش خطر انتقال باشد.[۳۹] همچنین گفته میشود تجاوز جنسی خطر انتقال HIV را افزایش میدهد چرا که در این حالت به ندرت از کاندوم استفاده میشود، آسیب فیزیکی واژن و یا مقعد محتمل است، و ممکن است خطر بیشتری برای انتقال همزمان عفونتهای جنسی وجود داشته باشد.[۴۰]
خون
دومین عامل شایع انتقال HIV، از طریق خون و فراوردههای خونی است.[۲] از راههایی که ممکن است این بیماری توسط خون منتقل گردد میتوان سرنگ مشترک در مواد مخدر تزریقی، زخم در اثر فرورفتن سرسوزن، انتقال خون آلوده و یا فراوردههای خونی، و یا تزریقهایی که با استفاده از تجهیزات پزشکی استریل نشده انجام میشود را نام برد. خطر سرنگ مشترک در حین تزریق مواد مخدر بین ۰٫۶۳ و ۲٫۴ درصد و به طور متوسط ۰٫۸٪ در هر عمل میباشد.[۴۱] خطر انتقال از فرورفتن سرسوزن یک فرد آلوده ۰٫۳٪ در هر عمل (حدود ۱ در ۳۳۳) و خطر آلودگی غشاء مخاطی به خون آلوده ۰٫۰۹٪ در هر عمل (حدود ۱ در ۱۰۰۰) تخمین زده میشود.[۲۶] در ایالات متحده، مصرف کنندگان مواد مخدر تزریقی ۱۲٪ از مبتلایان به HIV در سال ۲۰۰۹ را تشکیل میدادند[۳۱] و در برخی مناطق بیش از ۸۰٪ از افرادی که تزریق مواد انجام میدهد دارای HIV هستند.[۲]
در ۹۳٪ موارد استفاده از خون آلوده در انتقال خون، انتقال عفونت خواهد بود.[۴۱] در کشورهای توسعه یافته خطر ابتلا به HIV از طریق انتقال خون بسیار پایین است (کمتر از یک در پانصدهزار) و در آنها آزمایش HIV بر روی خون اهدا کننده انجام میشود.[۲] در انگلیس، خطر انتقال یک در پنج میلیون گزارش شدهاست.[۴۲] با این حال، در کشورهای با درآمد پایین، تنها نیمی از خون مورد استفاده برای انتقال ممکن است به طور مناسب آزمایش شود (در سال ۲۰۰۸).[۴۳] تخمین زده شدهاست که HIV در این مناطق تا ۱۵٪ از طریق انتقال خون آلوده و فراوردههای خونی سرایت مییابد، که نمایانگر ۵٪ تا ۱۰٪ از عفونتهای سرتاسر دنیا است.[۲][۴۴]
تزریق غیربهداشتی نقش مهمی در گسترش HIV در کشورهای جنوب صحرای آفریقا دارد. در سال ۲۰۰۷، بین ۱۲ تا ۱۷ درصد از عفونتهای این منطقه به دلیل استفاده از سرنگ نسبت داده شد.[۴۵] سازمان بهداشت جهانی خطر انتقال از طریق تزریق در آفریقا را ۱٫۲٪ تخمین زدهاست.[۴۵]
افرادی که خالکوبی، سوراخکاری و زخمآرایی انجام میدهند از لحاظ نظری در معرض خطر سرایت هستند، اما تاکنون هیچ مورد مستندی مشاهده نشدهاست.[۴۶] پشه و سایر حشرهها قادر به انتقال HIV نیستند.[۴۷]
مادر به فرزند
انتقال HIV از مادر به فرزند میتواند در دوران بارداری، هنگام زایمان یا از راه شیر مادر انجام شود.[۴۸][۴۹] این راه سومین طریق شایع انتقال HIV در دنیا میباشد.[۲] در صورت عدم درمان، خطر انتقال قبل یا در حین تولد حدود ۲۰ درصد و در کسانی که شیر هم بدهند ۳۵ درصد است.[۴۸] در سال ۲۰۰۸، حدود ۹۰٪ موارد HIV کودکان ناشی از انتقال عمودی محاسبه شد.[۴۸] با درمان مناسب خطر ابتلا به عفونت از مادر به فرزند میتواند به حدود ۱٪ کاهش یابد.[۴۸] درمان از طریق پیشگیری شامل مصرف داروی ضد ویروسی توسط مادر در دوران بارداری و زایمان، عمل سزارین در زمان مناسب (و نه اضطراری)، عدم تغذیه شیر مادر، و تجویز داروهای ضد ویروسی به نوزاد میشود.[۵۰] با این حال بسیاری از این امکانات در کشورهای در حال توسعه در دسترس نیست.[۵۰] اگر در دوران دندان آوردن، مواد غذایی به خون آلوده شود، میتواند خطر انتقال را افزایش دهد.[۴۶]
ویروسشناسی
ویروس HIV عامل گسترهای از بیماریهاست که با نام ایدز شناخته میشوند. HIV نوعی ویروس پسگرد است که عمدتاً به اجزای دستگاه ایمنی انسان مانند سلولهای CD4+ T، درشتخوارها و سلولهای دندریت سرایت میکند و به صورت مستقیم یا غیرمستقیم سلولهای CD4+ T را از بین میبرد.[۵۱]
HIV عضوی از سرده ویروسهای آهستهگستر ،[۵۲] و بخشی از خانواده ویروسان پسگرد است.[۵۳] ویروسهای آهستهگستر خصوصیات ریختشناسی و زیستشناسی مشترک بسیاری دارند. گونههای بسیاری از پستانداران مبتلا به ویروس آهستهگستر میشوند، که مشخصاً دلیل بیماریهای طولانیمدت با دوره کمون طولانی هستند.[۵۴] ویروسهای آهستهگستر به شکل تک رشته، حس مثبت، ویروس آرانای غلافدار منتقل میشوند. پس از ورود به سلول هدف، ژنوم آرانای ویروس توسط آنزیم وارونویس ویروسی که همراه با ژنوم ویروسی در ذرات ویروسی منتقل شده، به یک دیانای دو رشته استاندارد تبدیل میشود. سپس DNA ویروسی وارد هسته سلول میشود و کل DNAهای سلولی را توسط اینتگراز ویروسی فرا میگیرد.[۵۵] وقتی فرا گرفته شد، ویروس ممکن است پنهان شود و این به ویروس و سلولهای میزبانش این امکان را میدهد تا توسط دستگاه ایمنی بدنی شناسایی نشوند.[۵۶] همچنین این ویروس میتواند تکثیر شود و ژنومهای RNA جدیدی تولید کند و پروتئینهای ویروسی که توسط سلول به عنوان هستههای سلولی جدید شدهاند را در چرخهای از نو پدید آورد.[۵۷]
دو نوع ایدز تاکنون مشخص شدهاست: HIV-1 و HIV-2.
HIV-1 ویروسی بود که در ابتدا شناخته شد (و در ابتدا به عنوان LAV یا HTLV-III شناخته میشد). هر چه بیشتر بدخیم باشد، بیشتر عفونی میشود.[۵۸] عفونت ضعیفترHIV-2 در مقایسه با HIV-1 افرادی که در معرض HIV-2 هستند کمتر مبتلا به HIV-2 میشوند. از آنجا که HIV-2 توانایی ضعیفی در مقابل انتقال دارد، تا حد زیادی محدود به آفریقای غربی میباشد.[۵۹]
نتیجهٔ یک پژوهش علمی عمده و معتبر از سوی گروهی از پژوهشگران دانشگاه آکسفورد انگلستان نشان میدهد که ویروس اچآیوی در روند فرگشتی (تکاملی) خود، دچار دگرش و تحول شده و در مقایسه با گذشته، از میزان خطر، مرگبار بودن و مسری بودن آن کاسته شدهاست. بر اساس این مطالعه، ویروس اچآیوی در حال هماهنگی و تطبیق خود با دستگاه ایمنی بدن انسان بوده و درجهٔ خطر آن در حال کاهش است. بر اساس گزارش منتشر شده از این پژوهش، اکنون فاصلهٔ زمانی بین آلودگی به ویروس و بروز بیماری ایدز بیشتر شدهاست و ممکن است تغییرات تکاملی ایجاد شده در ویروس اچآیوی به نتیجهبخشی اقدامات و تلاشها برای مهار همهگیری گسترده و گسترش ابتلا به بیماری ایدز یاری رساند. به باور برخی ویروسشناسان، امکان دارد در ادامهٔ روند فرگشتی ویروس اچآیوی، در نهایت، این ویروس بیخطر شود. پیامد تلاش دائمی ویروس برای تغییر به منظور پنهان ماندن در برابر سامانهٔ ایمنی بدن انسان، کاهش توانایی تکثیر ویروس است. از سوی دیگر، بنا بر یافتههای این پژوهش، داروهای ضد ویروس در تضعیف و تحلیل ویروس اچآیوی دارای سهم بودهاند؛ به این شیوه که این داروها که ابتدا به نمونههای قویتر و پرخطرتر حمله کرده و آنها را از بین میبرند، باعث میشوند در فرایند انتخاب طبیعی (در این مورد، صفت مطلوب برای زنده ماندن، ضعیف بودن است چرا که داروها، ویروسهای قویتر و بیماریزاتر را زودتر مورد حمله قرار میدهند)، ویروسهای ضعیفتر و ملایمتر باقی بمانند و تکثیر شوند. البته اکنون، ضعیفترین نمونههای ویروسی هم کاملاً خطرناک هستند.[۶۰]
پاتوفیزیولوژی
پس از ورود ویروس به بدن، یک دوره سریع تکثیر ویروسی وجود داشته و منجر به بالا رفتن تعداد ویروس در خون اطراف خود خواهد شد. در طی عفونت اولیه، سطح HIV ممکن است به چند میلیون ذره ویروس در هر میلی لیتر خون برسد.[۶۱] این واکنش با کاهش قابل توجهی در تعداد سلولهای در گردش CD4+ T همراه است. این ویروس خونی حاد تقریباً همواره با فعالیت سلولهای CD8+ T در ارتباط است که سلولهای آلوده به HIV را از بین میبرد و سپس آنتیبادی تولید میکند. به نظر میرسد که واکنش سلول CD8+ T در کنترل سطح ویروس مهم باشد، که به اوج رسیده و سپس کاهش مییابد، تا شمار سلولهای CD4+ T به مقدار قبل بازگردد. واکنش یک سلول CD8+ T سالم هر چند که ویروس را از بین نمیبرد اما باعث میشود بیماری با سرعت کمتری پیشرفت کند و بهتر بتوان بیماری را شناسایی کرد.[۶۲]
پاتوفیزیولوژی بیماری ایدز پیچیده است.[۶۳] در نهایت، HIV با به تحلیل بردن سلولهای CD4+ T منجر به ایدز شده و باعث تضعیف دستگاه ایمنی بدن و عفونت فرصتطلب میشود. وجود سلولهای T برای واکنش ایمنی ضروری است و بدون آنها، بدن نمیتواند با عفونتها مقابله کند و یا سلولهای سرطانی را از بین ببرد. عملکرد کاهش سلولهای CD4+ T در وضعیت حاد و مزمن متفاوت است.[۶۴] در حین وضعیت حاد، سلولهای HIV ناشی از سلولهای عفونی تحلیل رفته و کشته شده توسط سلولهای سمی T، عامل کاهش سلولهای CD4+ T هستند، اگر چه عامل دیگر میتواند مرگ برنامهریزیشده یاخته باشد. در حین وضعیت مزمن، به نظر میرسد که عواقب ناشی از فعالیت کلی دستگاه ایمنی بدن همراه با از دست دادن تدریجی توانایی دستگاه ایمنی بدن برای تولید سلولهای جدید T عامل کاهش تدریجی تعداد سلولهای CD4+ T باشد.[۶۵] اگر چه علائم نقص دستگاه ایمنی توسط ایدز تا چند سال بعد از عفونت در فرد ظاهر نخواهد شد، ولی کمبود سلولهای CD4+ T در طول هفته اول عفونت، به خصوص در مخاط روده، که منبع اکثریت لنفوسیتهای موجود در بدن است، اتفاق میافتد.[۶۶] دلیل اصلی از دست رفتن سلولهای مخاطی CD4+ T این است که اکثر سلولهای مخاطی CD4+ T نشان دهنده پروتئین CCR5 هستند که HIV از آنها برای دستیابی به سلولها استفاده میکند، در حالی که تنها بخش کوچکی از سلولهای CD4+ T در جریان خون این کار را انجام میدهند.[۶۷]
ویروس HIV به دنبال CCR5 نشانگر CD4+ T میگردد و آنها را از بین میبرد.[۶۸] در نهایت، واکنش شدید دستگاه ایمنی عفونت را کنترل میکند و مرحله نهفتگی بالینی آغاز میگردد. سلولهای CD4+ T در بافت مخاطی باقی میمانند.[۶۸] تکثیر مداوم HIV از وضعیت کلی فعالیت ایمنی حاصل میشود.[۶۹] فعالیت دستگاه ایمنی که نمایانگر افزایش فعالیت سلولهای ایمنی و التهاب سیتوکین است، از فعالیت چندین محصول ژن HIV و واکنش دستگاه ایمنی به تکثیر HIV حاصل میشود. همچنین از کار افتادن دستگاه ایمنی گوارشی به وسیله تکثیر سلولهای مخاطی CD4+ T در طی مرحله عفونی بیماری به این موضوع مربوط میشود.[۷۰]
تشخیص بیماری
|
|
تعداد گویچههای سفید CD4+ T (سلول/میلیمتر مکعب) |
|
|
HIV RNA تکثیرشده بر میلیلیتر پلاسما |
بیماری ایدز و HIV با توجه بروز علایم و نشانههای بیمار، از طریق آزمایش و بررسی آن در آزمایشگاه تشخیص داده میشود.[۱۱] آزمایش HIV به همه کسانی که در معرض خطر قرار دارند توصیه میشود، که شامل هر فرد مبتلا به هر نوع بیماری آمیزشی است میشود.[۱۴] در بسیاری از مناطق دنیا، یک سوم حاملان HIV زمانی متوجه میشوند که در مرحله پیشرفتهای از این بیماری هستند و AIDS یا نقص شدید دستگاه ایمنی آشکار میشود.[۱۴]
آزمایش HIV
در اکثر افراد آلوده به HIV، در طول سه تا دوازده هفته پس از عفونت اولیه، یک سری آنتیبادیهای خاص ایجاد میگردد.[۱۳] تشخیص اولیه HIV قبل از تغییر آنتیبادی، با اندازهگیری اچآیوی-آرانای یا آنتیژن P24 انجام میشود.[۱۳] نتایج مثبت به دست آمده توسط آنتیبادی یا آزمایش واکنش زنجیرهای پلیمراز (PCR)، توسط PCR و یا توسط آنتیبادی دیگری تأیید میشوند.[۱۱]
آزمایش آنتیبادی در کودکان کمتر از ۱۸ ماه، به دلیل وجود مداوم آنتیبادیهای مادری معمولاً نتیجه درستی نمیدهند.[۷۱] بنابراین عفونت HIV تنها توسط آزمایش PCR مربوط به HIV RNA یا DNA و یا از طریق آزمایش آنتیبادی P24 قابل تشخیص است.[۱۱] در اکثر نقاط دنیا دسترسی به آزمایش PCR قابل اعتماد وجود ندارد و افراد باید تا زمانی صبر کنند که علائم پیشرفت کند و یا سن کودک به اندازه کافی باشد و آزمایش آنتی بادی درستی نتیجه دهد.[۷۱] در کشورهای جنوب صحرای آفریقا در بین سالهای ۲۰۰۷ و ۲۰۰۹، بین ۳۰ تا ۷۰ درصد افراد، از وضعیت HIV خود آگاه بودهاند.[۷۲] در سال ۲۰۰۹، بین ۳٫۶ تا ۴۲ درصد مردان و زنان کشورهای مختف جهان مورد آزمایش قرار گرفتند که کمترین میزان آزمایش (۳٫۶ درصد) متعلق به جمعیت مردان ماداگاسکار و بیشترین آن (۴۲ درصد) جمعیت متعلق به زنان لسوتو بوده است.[۷۲] این ارقام نشان دهنده افزایش قابل توجهی نسبت به ده سال گذشتهاست.[۷۲]
طبقهبندی عفونت HIV
از دو طبقهبندی اصلی برای مرحلهبندی HIV و ایدز استفاده میشود، یکی توسط سازمان بهداشت جهانی[۱۱] (WHO) و دیگر توسط مرکز کنترل و پیشگیری بیماری[۷۳] (CDC). برنامه CDC بیشتر در کشورهای توسعهیافته استفاده میشود. از آنجا که برنامه WHO احتیاجی به آزمایش ندارد، بیشتر مناسب کشورهای در حال توسعهاست که با کمبود لوازم روبرو هستند. علیرغم تفاوتهای که این دو با هم دارند، اما میتواند هر دوی آنها را از لحاظ آماری مقایسه نمود.[۹][۱۱][۷۳]
سازمان بهداشت جهانی برای اولین بار در سال ۱۹۸۶ تعریفی برای ایدز ارائه نمود.[۱۱] از آن زمان به بعد، مرحلهبندی WHO برای چندین بار تغییر کرده و گسترش یافت، که نسخهٔ اخیر آن که در سال ۲۰۰۷ منتشر شدهاست.[۱۱] ردهبندی مراحل تعیین شده توسط WHO به شکل زیر است:
- عفونت اولیه HIV: که یا بدون علامت است و یا همراه با سندرم حاد ویروسی است.[۱۱]
- مرحله ۱: عفونت HIV بدون علامت با تعداد سلولهای CD4 بیش از ۵۰۰ در هر میکرولیتر. ممکن است شامل بزرگ شدن گرههای لنفاوی نیز باشد.[۱۱]
- مرحله ۲: علائم خفیف که ممکن است تغییر جزئی غشاء مخاطی و عود عفونت دستگاه تنفسی فوقانی را شامل شود و تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر است.[۱۱]
- مرحله ۳: علائم پیشرفته که ممکن است شامل اسهال مزمن و غیر عادی برای بیش از یک ماه شود، به همراه عفونتهای باکتریایی شدید از جمله سل ریوی و همچنین تعداد سلولهای CD4 کمتر از ۳۵۰ در هر میکرولیتر.[۱۱]
- مرحله ۴ یا ایدز: علائم شدیدی شامل توکسوپلاسموز مغز، کاندیدیاز مری، نای، نایژه یا شش و سارکوم کاپوزی. تعداد سلولهای CD4 به کمتر از ۲۰۰ در هر میکرولیتر میرسد.[۱۱]
مرکز کنترل و پیشگیری بیماری آمریکا نیز ایجاد یک سیستم طبقهبندی برای HIV ارائه نموده و آخرین بار آن را در سال ۲۰۰۸ به روز رسانی کردهاست.[۷۳] در این سیستم عفونت HIV بر اساس شمارش CD4 و علائم بالینی میباشد،[۷۳] عفونت را در سه مرحله توصیف میکند:
- مرحله ۱: تعداد سلولهای CD4 بیشتر از ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۲: تعداد سلولهای CD4 بین ۲۰۰ تا ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۳: تعداد سلولهای CD4 کمتر از ۲۰۰ در هر میکرولیتر یا وجود علائمی از ایدز
- نامعلوم: اگر اطلاعات کافی برای هر یک از مراحل فوق در دسترس باشد
اگر پس از درمان، تعداد سلولهای CD4 خون به بیش از ۲۰۰ در هر میکرولیتر افزایش یابد و یا بیماری دیگری به جز ایدز احتمال رود و یا حتی درمان گردد هنوز هم تشخیص اینکه بیماری ایدز بوده باشد پابرجا خواهد بود.[۹]
پیشگیری
تماس جنسی
استفاده همیشگی از کاندوم در طولانی مدت، حدوداً ۸۰ درصد خطر انتقال HIV را کاهش میدهد.[۷۴] هنگامی که از بین زن و مرد، یکی از طرفین مبتلا شود، در صورتی که به طور مداوم از کاندوم استفاده شود، احتمال ابتلا به HIV برای فرد غیرآلوده در هر سال زیر ۱٪ است.[۷۵] برخی از شواهد نشان میدهد که کاندوم زنانه هم میتواند در همان سطح محافظت کند.[۷۶] به نظر میرسد استفاده از ژل واژینال حاوی تنوفوویر بلافاصله قبل از رابطه جنسی، میزان ابتلا را تا حدود ۴۰ درصد در میان زنان آفریقایی کاهش میدهد.[۷۷] در مقابل، استفاده از اسپرمکش نونوکسینول-۹، به دلیل ایجاد سوزش در واژن و رکتوم میتواند خطر انتقال را افزایش دهد.[۷۸] ختنه در آفریقای سیاه، خطر ابتلا به HIV توسط مردان دگرجنسگرا را بین ۳۸٪ و ۶۶٪ در بیش از ۲۴ ماه کاهش میدهد.[۷۹] بر پایه این مطالعات، سازمان جهانی بهداشت و UNAIDS، ختنه مرد را به عنوان یکی از روشهای پیشگیری انتقال HIV از زن به مرد در سال ۲۰۰۷ توصیه کردهاند.[۸۰] در این که آیا این کار باعث محافظت انتقال مرد به زن میشود، مناقشه است.[۸۱][۸۲] و این که آیا به نفع کشورهای توسعهیافته و در میان مردانی که با همجنس خود رابطه برقرار میکنند است، نامشخص است.[۸۳][۸۴][۸۵] زنانی که مورد ختنه قرار میگیرند، بیشتر در معرض خطر انتقال HIV قرار دارند.[۸۶]
به نظر نمیرسد که برنامههایی که پرهیز جنسی را تشویق میکنند بتوانند در مقابل خطر HIV موثر باشند.[۸۷] شواهد نشان میدهند که آموزش دوطرفه به همان اندازه ضعیف است.[۸۸] آموزش مسائل جنسی در مدارس میتواند رفتار پرخطر را کاهش دهد.[۸۹] اقلیت قابل توجهی از جوانان با اینکه نسبت به خطرات HIV و ایدز آگاه هستند، اما با این حال همچنان دست به کارهایی میزدند که پرخطر محسوب میشوند.[۹۰] مشخص نیست که آیا درمان سایر بیماریهای مقاربتی در پیشگیری از HIV موثر باشد یا خیر.[۳۷]
پیش از در معرض قرار گرفتن
درمان زودهنگام افراد مبتلا به HIV با ضدویروس، تا ۹۶ درصد از سرایت شریک آنها جلوگیری میکند.[۹۱][۹۲] پیشگیری پیش از در معرض قرارگرفتن با دوز معینی در روز از داروی تنوفوویر به همراه یا بدون امتریسیتابین بر روی بعضی از گروهها موثر است: مردانی که با مردان دیگر نزدیکی دارند، زوجهایی که یکی از آنها مبتلا به HIV است، و دگرجنسگراهای جوان در آفریقا.[۷۷]
به نظر میرسد اقدامات احتیاطی جهانی در محیط مراقبتهای بهداشتی بر روی کاهش خطر HIV موثر است.[۹۳] اعتیاد به مواد مخدر تزریقی عامل مهم دیگری است و راهبردهای کاهش آسیب مانند برنامه تعویض سرنگ و درمان جایگزین مواد مخدر ظاهراً در کاهش خطر انتقال موثر بودهاند.[۹۴]
پس از در معرض قرار گرفتن
پیشگیری پس از در معرض قرارگرفتن، دوره استفاده از آنتی رتروویرال (ضدویروس-آنتی رتروویروس) است که در طول ۴۸ تا ۷۲ ساعت پس از در معرض قرار گرفتن خون یا ترشحات تناسلی آلوده به HIV تجویز شده باشد.[۹۵][۹۶] استفاده از زیدوودین به تنهایی خطر ابتلا به عفونت HIV از طریق تزریق سرنگ را تا پنج برابر کاهش میدهد..[۹۶] این درمان بعد ازتجاوز جنسی و هنگامی که فرد متجاوز به عنوان مبتلا به HIV شناخته شده توصیه میشود، جای بحث دارد. اما در مواقعی که وضعیت HIV نامعلوم است،[۹۷] برنامههای درمانی فعلی معمولاً از لپیناویر/ریتوناویر و لمیودین/زیدوودین یا تنوفوویر/امتریسیتابین برای درمان استفاده میکنند و میتواند خطر را به میزان بیشتری کاهش دهند.[۹۶] طول دوره درمان معمولاً چهار هفته است[۹۸] و اغلب با عوارض جانبی (در حدود ۷۰٪ از موارد زیدوودین که شامل ۲۴٪ تهوع، ۲۲٪ خستگی، ۱۳ درصد روان پریشی و ۹٪ سردرد میشود) همراه هستند.[۲۶]
مادر به فرزند
برنامههای جلوگیری از انتقال HIV از مادر به فرزند میتواند سرعت انتقال را به اندازه ۹۲ تا ۹۹ درصد کاهش دهند.[۴۸][۹۴] این دوره اساساً شامل استفاده از داروهای ضدویروسی به صورت ترکیبی در دوره حاملگی و بعد از زایمان در بچه میشود و ترجیحاً باید به جای شیردهی از شیشه شیر استفاده شود.[۴۸][۹۹] اگر تغذیه جایگزین قابل قبول، امکانپذیر، مقرون به صرفه، پایدار و ایمن باشد، مادران باید از شیردهی به نوزادان خود خودداری کنند، با این حال در صورتی که موردی نباشد، شیر مادر در ماههای اول بسیار توصیه میشود.[۱۰۰] اگر تغذیه شیر فقط توسط مادر انجام شود، دوره پیشگیری طولانی مدت ضد ویروسی به نوزاد خطر انتقال را کاهش میدهد.[۱۰۱]
واکسیناسیون
تاکنون (سال ۲۰۱۴) هیچ گونه واکسن موثری برای ایدز کشف نشده است.[۱۰۲] در واکسن آزمایشی RV 144 که در سال ۲۰۰۹ منتشر شد کاهش جزئی تقریباً ۳۰٪ در خطر انتقال مشاهده شد، که باعث ایجاد امیدی در جامعه تحقیقای برای یک واکسن موثر شد.[۱۰۳] آزمایشهای بیشتری بر روی واکسن RV 144 در حال انجام است.[۱۰۴][۱۰۵]
درمان
در حال حاضر هیچ نوع درمان یا واکسن اچآیوی موثری برای این بیماری ساخته نشده است. معالجه شامل درمان از طریق مقابله با بازگشت ویروس (HAART) است که روند پیشروی بیماری را کند میکند.[۱۰۶] از سال ۲۰۱۰ بیش از ۶٫۶ میلیون نفر در کشورهای با درآمد پایین یا متوسط مبتلا به این بیماری شدهاند.[۷] همچنین درمان این بیماری شامل درمانهای پیشگیرانه و مداوم برای عفونتهای مترصد است.
درمان از طریق مقابله با ویروس
گزینههای فعلی HAART ترکیبی (یا «امتزاجی») از حداقل سه دارو است که دست کم دو نوع، یا «گونه»، عامل مقابله با بازگشت ویروسی را شامل میشود.[۱۰۷] درمان اولیه نوعاً یک مهارکننده ترانس کریپتاز معکوس آنالوگ غیر نوکلئوزیدی (NNRTI) به اضافه دو مهارکننده ترانس کریپتاز معکوس آنالوگ نوکلئوزیدی (NRTIs) است.[۱۰۷] NRTIs معمولاً شامل: زیدوودین (AZT) یا تنوفوویر (TDF) و لامیوودین (3TC) یا امتریسیتابین (FTC) است.[۱۰۷] ترکیب این عوامل که شامل مهار کننده پروتئازها (PI) میباشد و در صورتی که دستور بالا کارآیی لازم را نداشته باشد مورد استفاده قرار میگیرد.[۱۰۷]
زمان شروع درمان مقابله با بازگشت ویروس مورد مناقشه است.[۱۴][۱۰۸]هم سازمان بهداشت جهانی، هم دستورالعملهای اروپایی و هم ایالت متحده امریکا استفاده از درمان مقابله با بازگشت ویروس را در تمام افراد نوجوان، بزرگسال و زنان بارداری توصیه میکنند که CD4 آنها کمتر از ۳۵۰ میکرولیتر است یا بدون توجه به CD4 نشانههای بیماری را دارند.[۱۴][۱۰۷] این واقعیت که شروع درمان در این سطح خطر مرگ و میر را کاهش میدهد از این توصیه پشتیبانی میکند.[۱۰۹] علاوه بر این آمریکا این درمان را برای همه افراد آلوده به ویروس HIV بدون در نظر گرفتن CD4 و علایم آنها توصیه میکند، اگرچه، این توصیه را برای افرادی که میزان CD4 آنها بیشتر است با اطمینان کمتری تجویز میکند.[۱۱۰] این درحالی است که سازمان بهداشت جهانی این درمان را برای افراد مبتلا به بیماری سل و مبتلایان به هپاتیت ب مزمن و فعال پیشنهاد میکند.[۱۰۷] پیشنهاد میشود زمانی که این درمان آغاز شد بدون وقفه یا «تعطیلی» ادامه یابد.[۱۴] در بسیاری از افراد بیماری زمانی تشخیص داده میشود که زمان ایدهآل آغاز درمان از دست رفته است.[۱۴] نتیجه مطلوب درمان این است که در مدت زمان طولانی تعداد پلاسمای HIV-RNA زیر ۵۰ کپی بر میلیلیتر باشد.[۱۴] توصیه میشود سطوح تعیینکننده موثر بودن درمان در وهلهٔ اول بعد از چهار هفته اندازهگیری شوند و زمانی که سطوح به پایینتر از ۵۰ کپی بر میلیلیتر رسید معمولاً کنترل آن هر سه تا شش ماه یک بار کافی خواهد بود.[۱۴] به نظر میرسد که در کنترل ناموثر چیزی بیش ۴۰۰ کپی بر میلیلیتر دیده خواهد شد.[۱۴] بر اساس این معیار در بیش از ۹۵٪ از افراد درمان در سال اول موثر خواهد بود.[۱۴]
مزیتهای درمان شامل کاهش خطر پیشروی ایدز و کاهش خطر مرگ میباشد.[۱۱۱] همچنین در کشورهای در حال توسعه درمان باعث بهبود اوضاع جسمی و سلامت روحی فرد میشود.[۱۱۲] در صورت اقدام به درمان تا ۷۰٪ خطر ابتلا به سل کاهش خواهد یافت.[۱۰۷] مزیتهای دیگر درمان شامل کاهش خطر انتقال بیماری به شریک جنسی و کاهش امکان انتقال از مادر به فرزند میباشد.[۱۰۷] تاثیر درمان تا حد زیادی به انطباق بستگی دارد.[۱۴] دلایل عدم انطباق عبارتند از: دسترسی معدود به مراقبتهای پزشکی،[۱۱۳] عدم حمایتهای اجتماعی کافی، بیماری روانی و سوء مصرف مواد.[۱۱۴] همچنین پیچیدگی روشهای درمانی (به دلیل تعدد قرصها و دوزها) و اثرات جانبی آنها ممکن است موجب عدم تابعیت اختیاری فرد شود.[۱۱۵] البته در کشورهای با درآمد کم تابعیت از درمان افراد به خوبی کشورهایی است که افراد آن درآمد بالایی دارند.[۱۱۶]
عوارض جانبی خاص به داروی مصرفی مربوط میشوند.[۱۱۷] رایجترین آنها عبارتند از: سندرم دیستروفی، دیسلیپیدمی و مرض قند که به ویژه با مهارکنندههای پروتئاز عارض میشوند.[۹] سایر علائم شایع عبارتند از: اسهال،[۱۱۷][۱۱۸] و افزایش خطر ابتلا به بیماری قلبی-عروقی.[۱۱۹] البته عوارض جانبی برخی از درمانهای پیشنهاد شده اخیر کمتر هستند.[۱۴] مشکل برخی از داروها ممکن است گرانقیمت بودن آنها باشد.[۱۲۰] البته، از سال ۲۰۱۰، ۴۷٪ کسانی که به این داروها احتیاج پیدا میکنند متعلق به کشورهای با درامد کم یا متوسط هستند.[۷] برخی از داروها میتوانند موجب بیماری مادرزادی بشوند و بنابراین برای زنانی که امید به بچهدار شدن دارند مناسب نیست.[۱۴]
درمانهای پیشنهادی برای کودکان تا حدی متفاوت از درمان بزرگسالان است. در کشورهای در حال توسعه، از سال ۲۰۱۰، ۲۳٪ کودکانی که نیاز به معالجه داشتهاند تحت درمان قرار گرفتهاند.[۱۲۱] هم سازمان بهداشت جهانی و هم ایالت متحده امریکا توصیه میکنند که همه کودکان کمتر از دوازده ماه تحت درمان قرار بگیرند.[۱۲۲][۱۲۳] ایالت متحده برای کودکانی که بین یک تا پنج سال هستند توصیه میکند که آنهایی تحت درمان قرار بگیرند که میزانHIV RNA آنها بیشتر از ۱۰۰٫۰۰۰ کپی بر میلیلیتر باشد، و کودکانی که سن آنها بالای پنج سال است زمانی که تحت درمان قرار بگیرند که میزان CD4 آنها کمتر از ۵۰۰ در هر میکرولیتر باشد.[۱۲۲]
عفونتهای فرصتطلب
اقدامات انجام شده در جهت جلوگیری از عفونتهای فرصتطلب در بسیاری از افراد مبتلا به ایدز موثر میباشد. غالباً درمانهای ضد ویروسی عفونتهای فرصتطلب موجود را بهبود میدهند و همچنین باعث کاهش خطر ابتلا به آن در آینده میشوند.[۱۱۷] پیشنهاد میشود افرادی که در معرض ابتلا به HIV هستند قبل از ابتلا به عفونت خود را در برابر هپاتیت آ و ب واکسینه کنند، اگرچه بعد از عفونت نیز میتوانند این کار را انجام دهند.[۱۲۴] توصیه میشود برای نوزادان بین چهار تا شش هفته و نوزادانی که دوره استفاده از شیر مادر آنها به پایان رسیده و مادران آنها مبتلا به HIV، در موارد محدود از درمان پیشگیرانه تری متوپریم/سولفامتوکسازول استفاده شود.[۱۲۱] همچنین این دارو برای جلوگیری از PCP در افرادی که اندازه CD4 آنها کمتر از ۲۰۰ سلول بر میکرولیتر است و در کسانی که در حال حاضر یا قبلاً PCP داشتهاند توصیه میشود.[۱۲۵]به افرادی که از ایمنی قابل توجهی برخوردار هستند نیز توصیه میشود تا برای جلوگیری از ابتلا به توکسوپلاسموز و مننژیت کریپتوکوکوس از درمان پیشگیرانه بهرهمند شوند.[۱۲۶] بین سالهای ۱۹۹۲ و ۱۹۹۷اقدامات مناسب پیشگیرانه میزان ابتلا به این عفونتها را تا ۵۰٪ کاهش داده بود.[۱۲۷]
داروهای جایگزین
در آمریکا، تقریباً ۶۰٪ افراد مبتلا به HIV از اشکال مختلف داروهای مکمل یا جایگزین استفاده میکنند.[۱۲۸] البته موثر بودن اکثر این درمانها تایید نشده است.[۱۲۹]با توجه به مشاوره رژیم غذایی، برخی از شواهد نشان میدهند که مصرف ریزخوراکهای مکمل سودمند است.[۱۳۰] شواهد تجربی و آزمایشها نشان دادهاند که مکملهایی که دارای سلنیم هستند نیز فایدهمند هستند.[۱۳۱] شواهدی وجود دارند که نشان میدهند مصرف مکمل ویتامین آ در کودکان میزان مرگ و میر را کاهش داده و روند رشد را بهبود میبخشد.[۱۳۰] در آفریقا در زنان باردار و شیرده که در معرض خطر کمبود مواد مغذی هستند مصرف مولتی ویتامین منجر به بهبود وضعیت مادر و فرزند شده است.[۱۳۰] سازمان بهداشت جهانی مصرف غذایی ریزخوراکها در سطوح RDA بزرگسالان مبتلا به HIV را توصیه میکند.[۱۳۲][۱۳۳] سازمان بهداشت جهانی اعلام کرده است که تحقیقات متعدد نشان دادهاند مکمل ویتامین آ، روی و آهن میتواند باعث بروز عوارض HIV در بزرگسالان مبتلا به این بیماری شود.[۱۳۳] شواهد کافی برای حمایت از مصرف داروهای گیاهی وجود ندارد.[۱۳۴]
نتایج بررسیهایی که به طور همزمان در نشریات (Science) و (Nature) به چاپ رسیده است، نشان میدهد یک داروی آزمایشی ضدالتهاب که توسط شرکت ورتکس (Vertex) تولید شده است و پیش از این روی مبتلایان به بیماری صرع آزمایش شده است احتمالاً به عنوان داروی جدید ضد ایدز نیز قابل استفاده است. دانشمندان سالها تصور میکردند ویروس ایدز با حمله مستقیم، سلولهای ایمنی را میکشد و بر ساز و کار دی ان ای آنان مسلط میشود و از آن برای تکثیر خودش استفاده میکند. ولی این مسئله تنها برای درصد اندکی از سلولهای ایمنی (CD۴T) اتفاق میافتد. چراکه بررسیها نشان دادهاست زمانی که سلولهای ایمنی (CD۴T) به ویروس ایدز حمله میکنند و نمیتوانند آن را از بین ببرند، نوعی پروتئین تولید میکنند و این پروتئین آنزیمی به نام کاسپاس-۱ (caspase-۱)را فعال میکند و این آنزیم، سبب خودکشی سلولها میشود. به گفتهٔ دکتر وارنر گرین پژوهشگری که این تحقیق را انجام داده است: از بین رفتن سلولهای ایمنی سی دی۴ تی بیش از آن که به علت حمله ویروس ایدز باشد ناشی از سیستم خودنابودی آنها است. دانشمندان از داروی شرکت ورتکس برای جلوگیری از فعال شدن این آنزیم کاسپاس-۱ کمک میگیرند.[۱۳۵]
پیشبینی
|
بدون داده ≤ ۱۰ ۱۰–۲۵ ۲۵–۵۰ ۵۰–۱۰۰ ۱۰۰–۵۰۰ ۵۰۰–۱۰۰۰
|
۱۰۰۰–۲۵۰۰ ۲۵۰۰–۵۰۰۰ ۵۰۰۰–۷۵۰۰ ۷۵۰۰-۱۰۰۰۰ ۱۰۰۰۰-۵۰۰۰۰ ≥ ۵۰۰۰۰
|
ایدز در بسیاری از مناطق دنیا بیشتر به عنوان یک بیماری مزمن شناخته میشود تا یک بیماری عفونی کشنده.[۱۳۶] شیوع آن بین افراد متفاون بوده، و هر دوی شمار سلولهای CD4 و بار ویروسی برای پیشبینی نتایج مفید هستند.[۱۳] بدون درمان، مدت زمان زنده ماندن پس از عفونت HIV به طور متوسط ۹ تا ۱۱ سال تخمین زده میشود، که به نوع HIV نیز بستگی دارد.[۱۳۷] پس از تشخیص ایدز، اگر درمان در دسترس نباشد، مدت زنده ماندن بین ۶ تا ۱۹ ماه خواهد بود.[۱۳۸][۱۳۹] HAART و پیشگیری مناسب از عفونتهای فرصت طلب میزان مرگ و میر را تا ۸۰٪ کاهش میدهد، و امید به زندگی برای یک فرد بالغ ۲۰ تا ۵۰ سال را افزایش میدهد.[۱۳۶][۱۴۰][۱۴۱] این مقدار بین دو سوم[۱۴۰] و تقریباً کل جمعیت است.[۱۴][۱۴۲] اینکه درمان دیرهنگام بعد از تشخیص عفونت آغاز گردد خوب نیست،[۱۴] برای نمونه اگر درمان پس از تشخیص ایدز آغاز گردد، امید به زندگی ۱۰ تا ۴۰ سال خواهد بود.[۱۴][۱۳۶]نیمی از کودکانی که مبتلا به HIV به دنیا میآیند بدون درمان قبل از دو سالگی میمیرند.[۱۲۱]
عوامل اصلی مرگ با ایدز، عفونت فرصتطلب و سرطان میباشد، هر دوی آنها در خیلی از موارد نتیجه از کارافتادگی تدریجی دستگاه ایمنی میباشند.[۱۲۷][۱۴۳] به نظر میرسد که وقتی شمار سلولهای CD 4 به کمتر از ۵۰۰ در هر میکرولیتر برسد، خطر سرطان افزایش مییابد.[۱۴] میزان پیشرفت بالینی بیماری در هر فرد متفاون است و ثابت شده است که تحت تاثیر عواملی چون مستعد بودن فرد، عملکرد دستگاه ایمنی،[۱۴۴] دسترسی آنها به موسسههای بهداشت و حضور عفونتهای دیگر میباشد،[۱۳۸][۱۴۵] و همچنین گونه (یا گونههای) بخصوصی از ویروس را شامل میشود.[۱۴۶][۱۴۷]
سل یکی از عوامل عمده بیماری و مرگ مبتلایان به ایدز است و در یک سوم افراد مبتلا به HIV ظاهر میشود و علت مرگ ۲۵ درصد موارد HIV میباشد.[۱۴۸] همچنین HIV مهمترین عامل ابتلا به سل میباشد.[۱۴۹] هپاتیت سی عفونت رایج دیگری است که هر بیماری پیشرفت بیماری دیگر را افزایش میدهد.[۱۵۰] دو سرطان رایجی در ارتباط با ایدز، سارکوم کاپوزی و لنفوم غیر هاجکین است.[۱۴۳]
حتی با درمان ضد ویروسی، افراد آلوده به HIV در دراز مدت ممکن است دچار اختلالات عصبی،[۱۵۱] پوکی استخوان،[۱۵۲] بیماری عصبی،[۱۵۳] سرطان،[۱۵۴][۱۵۵] سرطان کلیه،[۱۵۶] و بیماری قلبی-عروقی[۱۱۸] شوند. دقیقاً مشخص نیست که این علائم حاصل عفونت HIV و یا از اثرات درمان هستند.
گسترهٔ شیوع
ایدز یک بیماری همهگیر جهانی است.[۱۵۷] تا سال ۲۰۱۰ حدود ۳۴ میلیون نفر در دنیا مبتلا به HIV بودهاند.[۷] از اینها تقریباً ۱۶٫۸ میلیون زن و ۳٫۴ میلیون زیر ۱۵ سال بودهاند.[۷] نتیجه آن حدود ۱٫۸ میلیون مرگ در سال ۲۰۱۰ بوده که این مقدار نسبت به سال ۲۰۰۱ که ۳٫۱ میلیون نفر بوده، کاهش یافتهاست.[۷]
کشورهای جنوب صحرای آفریقا، تاثیرپذیرترین منطقه هستند و در سال ۲۰۱۰، تخمین زده شد که ۶۸ درصد (۲۲٫۹ میلیون نفر) کل موارد HIV و ۶۶٪ از همه مرگ و میرها (۱٫۲ میلیون) در این منطقه رخ داده است.[۱۵۸] این نشان میدهد که در حدود ۵ درصد از جمعیت بزرگسال آلوده هستند.[۱۵۹] و به نظر میرسد که عامل ۱۰ درصد از مرگ و میر در کودکان میباشد.[۱۶۰] در مقایسه با سایر مناطق، زنان نزدیک به ۶۰ درصد از موارد را تشکیل میدهند.[۱۵۸] آفریقای جنوبی با ۵٫۹ میلیون نفر، دارای بیشتری جمعبت افراد مبتلا به HIV نسبت به سایر کشورهای دنیاست.[۱۵۸] امید به زندگی در کشورهای متاثر به دلیل ایدز کاهش یافته است، برای مثال در سال ۲۰۰۶ این عدد از بوتسوانا از ۶۵ به ۳۵ کاهش یافته است.[۸]
جنوب و جنوب شرق آسیا دومین منطقه آسیب دیده است، در این منطقه در سال ۲۰۱۰، به طور تخمینی ۴ میلیون یا ۱۲٪ افراد مبتلا به HIV زندگی میکردهاند که ۲۵۰ هزار نفر از آنها منجر به مرگ شده است.[۱۵۹] حدود ۲٫۴ میلیون مرد در هند هستند.[۱۵۸] میزان شیوع در اروپای غربی و مرکزی با ۰٫۲٪ و در آسیای شرقی با ۰٫۱٪ کمترین مقدار را دارد.[۱۵۹]
در سال ۲۰۰۸ در ایالات متحده آمریکا حدود ۱٫۲ میلیون نفر مبتلا به HIV بودهاند، و در حدود ۱۷،۵۰۰ از آنها منجر به مرگ شدهاست. مرکز کنترل و پیشگیری بیماری تخمین زده است که در سال ۲۰۰۸، ۲۰ درصد از آمریکاییهای آلوده از بیماری خود بی اطلاع بودهاند.[۱۶۱] در انگلستان در سال ۲۰۰۹ در حدود ۸۶،۵۰۰ مورد وجود داشته که ۵۱۶ مورد از آن منجر به مرگ شده است.[۱۶۲] در کانادا در سال ۲۰۰۸ در حدود ۶۵،۰۰۰ مورد وجود داشته که ۵۳ مورد از آن منجر به مرگ شده است.[۱۶۳] ایدز از زمان شناخته شدن برای نخستین بار در سال ۱۹۸۱ تا سال ۲۰۰۹ باعث مرگ نزدیک به ۳۰ میلیون نفر شده است.[۶]
ایران
راههای اصلی انتقال ایدز در ایران، آمیزش جنسی و استفادهٔ معتادان تزریقی از سرنگ مشترک است. سهم ابتلا از طریق تزریق ۶۹٫۵ درصد و سهم ابتلا از طریق رابطه جنسی ۱۰ درصد است.[۱۶۴] اگر چه میزان مبتلایان به بیماری ایدز در ایران کم بودهاست،[۱۶۵] ولی به گفته سازمان بهداشت جهانی بر اساس دادههای گزارش شده، نرخ رشد اپیدمی ایدز در ایران به صورت هشدار دهندهای در حال افزایش است.[۱۶۶]
آمار تجمعی وزارت بهداشت از سال ۱۳۶۵ تا ۱۳۹۰، ۲۳ هزار و ۱۲۵ نفر مبتلا به HIV در کشور ثبت شده که ۹۱٫۵ درصد آنها مرد و ۸٫۵ درصد هم زن بوده و حدود ۴۶٫۵ درصد از آنها در گروه سنی ۲۵ تا ۳۴ سال قرار دارند. از این تعداد ۳۰۵۳ نفر دچار ایدز و ۴۳۱۱ نفر هم دچار مرگ شدهاند.[۱۶۴] با فرمول «تخمین موارد واقعی بر اساس موارد ثبت شده» حاصل از مدل اپیدمیولوژیک UNAIDS و سازمان جهانی بهداشت،[۱۶۴] حدود ۸۰ هزار نفر HIV مثبت و بر اساس آمار غیر رسمی، ۱۲۰ هزار ناقل HIV در ایران وجود دارد.[۱۶۷]
نخستین مورد گزارش و ثبت شدهٔ ابتلا به ایدز در ایران مربوط به سال ۱۳۶۶ و در مورد یک کودک شش ساله مبتلا به بیماری هموفیلی است که فراوردههای خونی آلوده دریافت کرده بود که از فرانسه به ایران منتقل شده بود. در سالهای اولیهٔ شیوع بیماری، وجود ایدز در ایران اساساً انکار میشد. در ارتباط با این بیماری دو پروندهٔ قضایی عمده وجود دارد. پروندهٔ برادران علایی پزشکانی که برای فعالیتهایشان در زمینه شناساندن و مبارزه با بیماری ایدز در ایران شهرت بینالمللی دارند و به اتهام مخالفت با حکومت در سال ۱۳۸۷ بازداشت و حبس شدند که اعتراضات گستردهٔ بینالمللی را در پی داشت.[۱۶۸]
تاریخچه
کشف
ایدز اولین بار در سال ۱۹۸۱ در امریکا مشاهده شد.[۲۱] اولین مواردی که مشاهده شد در بین معتادان تزریقی و همچنین همجنسگرایان مرد قرار داشت که به دلیل نامعلومی سیستم دفاعی بدن آنها ضعیف شده بود و علایم بیماری التهاب ریه پنوموسیستیک کارینی (PCP) در آنها مشاهده میشد که این بیماری در افرادی دیده میشود که سیستم دفاعی بدنی ضعیفی دارند.[۱۶۹] سپس نوعی سرطان پوست نادر با نام کاپوسی سارکوما (KS) در میان مردان همجنسگرا گزارش شد.[۱۷۰][۱۷۱] موارد بیشتری از بیماری PCP و KS مشاهده شد و این زنگ خطری برای مرکز پیشگیری و کنترل بیماری بود و گروهی از طرف این مرکز برای بررسی این واقعه تشکیل شد.[۱۷۲]
در آن اوایل مرکز کنترل بیماری هنوز نامی رسمی برای این بیماری انتخاب نکرده بود و معمولاً نام این بیماری را با بیماری که مریض با آن در ارتباط بود بیان میکردند، برای مثال تا قبل از کشف HIV از نام لنفادنوپاتی که بیماری عامل بود استفاده میشد.[۱۷۳][۱۷۴] همچنین اسامی مانند سارکوم کاپوزی یا عفونت فرصتطلب نامهایی بودهاند که توسط این گروه در سال ۱۹۸۱ استفاده میشدهاست.[۱۷۵] از آنجا که این سندرم در هائیتی، همجنسگرایان، هموفیلی، و مصرف کنندگان هروئین ظاهر شده بود، مرکز کنترل بیماری عبارت «بیماری ۴ه» را ابداع کرد.[۱۷۶] در مطبوعات از اصطلاح «گرید» که مخفف معادل انگلیسی عبارت نقص ایمنی مرتبط با همجنسگرایی استفاده میشد.[۱۷۷] اما بعداً که معلوم شد که ایدز فقط محدود به جامعه همجنسگرایان نمیشود،[۱۷۵] این نتیجه گرفته شد که استفاده از اصطلاح گرید گمراهکننده است و واژه ایدز در همایشی در ژوئیه ۱۹۸۲ معرفی شد.[۱۷۸] از سپتامبر ۱۹۸۲، مرکز کنترل بیماری از واژه ایدز برای نسبت دادن این بیماری استفاده کرد.[۱۷۹]
در سال ۱۹۸۳، دو گروه تحقیقاتی جداگانه به رهبری رابرت گالو و لوک مونتانیه به طور مستقل اعلام کردند که یک ویروس پسگرد جدید بیماران مبتلا به ایدز را آلوده کرده، و یافتههایشان را در یک شماره از مجله ساینس منتشر کردند.[۱۸۰][۱۸۱] گلو ادعا کرد که ویروسی که گروه خود از یک بیمار مبتلا به ایدز برای تحقیقات جدا کرده بود از نظر شکل کاملاً مشابه سایر ویروسهای تی-لنفوتروپیک انسانی (HTLV) بوده که گروهش در همان ابتدا جدا کرده بود. گروه گالو نام آن ویروس را HTLV-III گذاشتند. در همان زمان، گروه مونتانیه ویروسی از یک بیمار مبتلا به تورم غدد لنفاوی گردن و ضعف فیزیکی که دو مشخصه از علائم ایدز است، جدا کرده بود. تناقض در گرازشهای گروه گالو و مونتانیه و همکارانشان نشان میداد که هسته پروتئینهای این ویروس از لحاظ ایمنیشناسی، کاملاً متفاوت از HTLV-I است. گروه مونتانیه اسم ویروسی که جدا کرده بودند را ویروس مرتبط با لنفادنوپاتی (LAV) گذاشتند.[۱۷۲] از آنجا که مشخص شد هر دوی این ویروسها یکسان هستند، در سال ۱۹۸۶ LAV و HTLV-III هر دو به HIV تغییر نام دادند.[۱۸۲]
منشأ
اچآیوی شکلی جهشیافته از ویروسی است که شامپانزهها را گرفتار میکند و ویروس «نقص ایمنی میمونی» نام دارد.[۱۸۳] به نظر میرسد که هر دو ویروس HIV-۱ و HIV-۲ در اصل متعلق به نخستیسانان مرکز آفریقا بوده و در اوایل سده بیستم میلادی به بدن انسان منتقل شدهاند.[۴] به نظر میآید که ویروس HIV-۱ در اصل متعلق به مناطق جنوبی کامرون و تکامل یافتهٔ ویروس نقص ایمنی میمونی (SIV) که در میان شمپانزههای وحشی شیوع دارد، بودهاست.[۱۸۴][۱۸۵] ویروس HIV-۲ تکامل یافتهٔ ویروس SIV میان گونهای میمون به نام منگابی دودی بودهاست که در غرب افریقا (از جنوب سنگال تا غرب ساحل عاج) زندگی میکردهاست.[۵۹] پخبینیانی مانند میمون شب نسبت به ویروس HIV-۱ مقاوم هستند و این احتمالاً به دلیل یک نوع ژن پیوندی دو گونه مقاوم ویروس در آنها میباشد.[۱۸۶] به نظر میرسد که HIV-1 حداقل در سه مرحله جهش داشته و به سه گروه از ویروسهای M، N و O جهش یافته است.[۱۸۷]
مدارکی موجود است که نشان میدهد انسانهایی که در شکار و یا فروش حیوانات دخالت داشتند دچار ویروس SIV شدهاند.[۱۸۸] اگرچه SIV ویروس ضعیفی است که سیستم دفاعی بدن انسان با آن مقابله میکند و بیش از چند هفته در بدن انسان باقی نمیماند، اما انتقال سریع و متوالی آن بین انسانهای مختلف زمان کافی را به این ویروس برای تبدیل آن به HIV میدهد.[۱۸۹]
برای شناسایی منشاء ایدز، پژوهشگران[۱۹۰] رشته فعالیتهایی در حوزه دیرینشناسی ویروسها داشتند و با استفاده از نمونههایی بایگانیشده از کدهای ژنتیکی اچآیوی، توانستند این ویروس را ردیابی کنند و به دهه ۱۹۲۰ میلادی در کینشاسا، واقع در جمهوری دموکراتیک کنگو برسند..[۱۹۱]
مطالعات ژنتیکی ویروسی نشان میدهد که اجداد گروه اچآیوی-۱ M به سال ۱۹۱۰ بر میگردد.[۱۹۲] افرادی که مدعی هستند که HIV در این تاریخ شیوع یافته، آن را به ظهور و رشد استعمار و شهرهای مستعمره آفریقایی ارتباط میدهند که منجر به تغییرات اجتماعی شامل بی بند و باری جنسی، گسترش تنفروشی، و بیماریهای زخم تناسلی (مانند سیفیلیس) در شهرهای مستعمره شده است.[۱۹۳] در حالی که میزان انتقال HIV در رابطه جنسی واژینال در حالت عادی کم است، اما اگر یکی از طرفین مبتلا به یک بیماری آمیزشی عفونی باشد، احتمال انتقال هم افزایش خواهد یافت. در اوایل دهه ۱۹۰۰ شهرهای مستعمره به دلیل شیوع بالای تنفروشی و بیماریهای زخم تناسلی معروف بودند و به نظر میرسید که در سال ۱۹۲۸ به اندازه ۴۵٪ زنان ساکن کینشاسا شرقی تنفروشی میکردند و در سال ۱۹۳۳ در حدود ۱۵٪ ساکنان همان شهر به یکی به بیماری سیفیلیس مبتلا شده بودند.[۱۹۳]
از نگاهی دیگر مشاهده میشود که اعمال خطرناک پزشکی در آفریقا در طول جنگ جهانی دوم، مانند استریل نبودن، استفاده مجدد از سرنگها در واکسنهای عمومی، آنتیبیوتیک و آنتیمالاریا از عواملی بودهاند که باعث پخش ویروس و سازگاری آن با انسانها شده است.[۱۸۹][۱۹۴][۱۹۵]
بررسی نمونههای خونی به جا مانده از گذشته نشان میدهد که اولین انسانی که مبتلا به ایدز شده در سال ۱۹۵۹ در کنگو جان خود از دست دادهاست. این نخستین و قدیمیترین مورد مرگ شناخته شده در اثر ابتلا به این بیماری محسوب میشود.[۱۹۶] همچنین ممکن است ویروس اچآیوی نخستین بار در سال ۱۹۶۶ به آمریکا رسیده باشد،[۱۹۷] ولی عمده شیوع HIV مربوط به خارج از صحرای آفریقا (و همچنین امریکا) میشود و میتوان آن را به فردی ناشناس و مبتلا به ایدز نسبت داد که در هائیتی زندگی میکردهاست و با ورود به امریکا در سال ۱۹۶۹ به آن شیوع بخشیدهاست.[۱۹۸] پس از آن به سرعت بین گروههای پرخطر (در ابتدا در بین مردان هوسباز همجنسگرا) پخش شد. در سال ۱۹۷۸ شیوع ویروس HIV-1 در بین مردان همجنسگرای ساکن نیویورک و سان فرانسیسکو، ۵ درصد تخمین زده شد که بیانگر این است که هزاران نفر در کشور مبتلاً به ایدز بودهاند.[۱۹۸]
جامعه و فرهنگ
داغ ننگ
در سراسر دنیا داغ ننگ به طرق مختلف در مورد ایدز وجود دارد، از قبیل محرومیت از حقوق اجتماعی، عدم پذیرش از سوی جامعه، تبعیض و دوری از افراد مبتلا به HIV، اجبار به انجام آزمایش HIV بدون رضایت قبلی یا مخفی نگه داشتن این راز، خشونت علیه افراد مبتلا به HIV که بیمار بودن آنها فاش شده است و قرنطینه افراد مبتلا به HIV.[۱۹۹] خشونتهای مربوط به داغ ننگ یا ترس از خشونت مانع از آن میشود که بسیاری از افراد به دنبال آزمایشهای HIV، گرفتن جواب آزمایش، یا انجام درمان آن باشند، مسایلی که میتوانند چنین بیماری مزمن مدیریت پذیری را تبدیل به حکم مرگ کنند و باعث گسترش آن بشوند.[۲۰۰]
داغ ننگ ایدز را میتوان به سه مقوله تقسیم کرد:
- داغ ننگ ابزاری ایدز – بازتابی از ترس و هراسی است که ممکن است با هر بیماری مرگبار و قابل انتقال دیگری نیز همراه باشد.[۲۰۱]
- داغ ننگ نمادین ایدز – استفاده از ایدز برای بیان نگرشهای مربوط به گروههای اجتماعی یا سبک زندگی همراه با این بیماری.[۲۰۱]
- داغ ننگ احترام به ایدز – انگزنی به افرادی که با مسایل مربوط به ایدز درگیر هستند یا افراد مبتلا به HIV.[۲۰۲]
غالباً، داغ ننگ ایدز در ارتباط با سایر داغهای ننگ بیان میشود به خصوص داغهای مربوط به همجنسگرایی، دوجنسگرایی، بیبند و باری جنسی، فحشا، و ترزریق درون وریدی مواد مخدر.[۲۰۳]
در بسیاری از کشورهای توسعهیافته، ارتباط نزدیکی بین ایدز و همجنسگرایی، یا دوجنسگرایی وجود دارد، و این تداعی مرتبط است با سطوح بالاتری از نگرشهای موجود درباره قضاوتهای جنسی از قبیل ترس از همجنسگرایی/دوجنسگرایی.[۲۰۴] همچنین بین ایدز و رفتارهای جنسی مرد با مرد، مانند رابطه جنسی میان افراد غیرآلوده رابطه نزدیکی وجود دارد.[۲۰۱] البته حالت غالب در گسترش HIV در تمام دنیا انتقال از طریق دوجنسگرایان است.[۲۰۵]
تاثیرات اقتصادی
|
|
بوتسوانا |
|
|
زیمبابوه |
|
|
کنیا |
|
|
آفریقای جنوبی |
|
|
اوگاندا |
ایدز هم بر اقتصاد افراد و هم کشورها تاثیر میگذارد.[۱۶۰] تولید ناخالص داخلی بیشتر کشورهای تحت تاثیر به خاطر فقدان سرمایه انسانی کاهش یافته است.[۱۶۰][۲۰۶] بدون تغذیه، بهداشت و داروی مناسب، بسیاری از مردم به دلیل اثرات ناشی از ایدز جان خود را از دست خواهند داد. آنها نه تنها قادر به کار کردن نیستند، بلکه نیازمند مراقبتهای پزشکی خاصی نیز هستند. براورد شده است که از سال ۲۰۰۷ تعداد ۱۲ میلیون کودک به خاطر ایدز یتیم شدهاند.[۱۶۰] بسیاری از آنها توسط پدربزرگ و مادربزرگهای پیر خود نگهداری میشوند.[۲۰۷]
از آنجا که غالباً جوانان مبتلا به ایدز میشوند، این بیماری جمعیت مشمول مالیات را کاهش میدهد، و در عوض منابع موجود برای هزینههای عمومی از قبیل آموزش و پرورش و خدمات بهداشتی که ارتباطی با ایدز ندارند کاهش مییابند و در نتیجه فشارها بر منابع مالی دولت افزایش یافته و رشد اقتصاد کاهش مییابد. این مسئله موجب کند شدن رشد پایه مالیاتی میشود، و اگر هزینههای عمومی برای درمان بیماران، آموزش افراد جدید (برای جایگزین کردن کارگران بیمار)، حقوق بیمار و مراقبت از کودکان یتیم شده به خاطر ایدز افزایش یابند، وضعیت بغرنجتر خواهد شد.[۲۰۷]
در سطح خانواده، ایدز هم بر پایین آمدن سطح درامد تاثیر خواهد گذاشت و هم موجب افزایش هزینههای درمانی میشود. مطالعهای در ساحل عاج نشان داده است هزینههای درمانی خانوادههایی که بیماران HIV/ایدز دارند، دو برابر سایر خانوادههاست. این هزینههای اضافی همچنین باعث میشود که برای آموزش و پرورش و سایر سرمایهگذاریهای شخصی و خانوادگی هزینههای کمتری مصرف شود.[۲۰۸]
مذهب و ایدز
موضوع مذهب و ایدز در بیست سال گذشته به شدت بحث برانگیز بوده است، اول از همه به این دلیل که برخی از مقامات دینی به طور عمومی مخالفت خود را با استفاده از کاندوم بیان داشتهاند.[۲۰۹][۲۱۰] کارشناس بهداشت متیو هنلی طی گزارشی با عنوان کلیسای کاتولیک و بحران جهانی ایدز در مورد رویکرد دینی برای جلوگیری از گسترش ایدز بیان میدارد که تغییرات فرهنگی از قبیل تاکید دوباره بر وفاداری به همسر و اجتناب از رابطه جنسی خارج از این چارچوب امری ضروری است.[۲۱۰] برخی از سازمانهای مذهبی ادعا کردهاند که عبادت میتواند اچ آی وی/ایدز را درمان کند. در سال ۲۰۱۱، بیبیسی گزارش کرد که برخی از کلیساها در لندن ادعا میکردند که عبادت موجب درمان ایدز میشود، و مرکز مستقر در هاکنی در مطالعه بهداشت جنسی و HIV گزارش داده است که چندین نفر به پیشنهاد پیشوای روحانی خود درمان بیماریشان را متوقف کردند و جان خود را از دست دادند.[۲۱۱] کلیسای کنیسه «آب تدهین» را به عنوان چیزی تبلیغ میکند که باعث شفای بیمار از طرف خدا میشود، این درحالیست که گروهی انکار میکنند که مانع بیماران از مصرف دارو شدهاند.[۲۱۱]
تصویرسازی رسانهها
یکی از مشهورترین شخصیتهای مبتلا به ایدز راک هادسن آمریکایی، بازیگر همجنسگرایی است که در ابتدای زندگی خود یک بار ازدواج کرد و طلاق گرفت، وی در ۲ اکتبر ۱۹۸۵ اعلام کرد که در ۲۵ ژوئیه آن سال مبتلا به ویروس شده است. بیماری او در سال ۱۹۸۴ تشخیص داده شدهبود.[۲۱۲] قابل توجهترین تلفات بریتانیا از ایدز در آن سال نیکولاس ادن، سیاستمدار همجنسگرا و پسر نخست وزیر سابق آنتونی ادن بود.[۲۱۳] در ۲۴ نوامبر ۱۹۹۱، ویروس زندگی ستاره راک بریتانیایی فردی مرکوری، خواننده گروه کوئین را گرفت، وی در حالی از بیماری مرتبط با ایدز جان سپرد که تنها روز قبل از مرگش بیماری خود را در رسانهها اعلام کرده بود.[۲۱۴] البته، در سال ۱۹۸۷ تشخیص داده شده بود که وی مبتلا به HIV است.[۲۱۵] یکی از معروفترین چهرههای دگرجنسگرای مبتلا به ایدز آرتور اش، بازیکن آمریکایی تنیس است. در ۳۱ اوت ۱۹۸۸ تشخیص داده شد که وی مبتلا به HIV است، ویروس از راه انتقال خون طی جراحی قلب در اوایل دهه ۱۹۸۰ به او منتقل شده بود. آزمایشهای بیشتر در عرض ۲۴ بعد از تشخیص اولیه نشان دادند که اش ایدز دارد، اما او تا آوریل ۱۹۹۲ به عموم چیزی نگفت.[۲۱۶] وی در سن ۴۹ سالگی در تاریخ ۶ فوریه ۱۹۹۳ بر اثر این بیماری جان خود را از دست داد.[۲۱۷]
عکس ترزا فرار از یکی از فعالان همجنسگرای، دیوید کیربی، درحالیکه بر روی تخت به دلیل بیماری ایدز جان خود را از دست داده بود و خانوادهاش در اطرافش بودند، در آوریل ۱۹۹۰ گرفته شده بود. مجله لایف ادعا کرد که این عکس تبدیل به تصویری شد که «به نحوی قدرتمند مسری بودن ایدز را نشان میدهد.» این عکس که در مجله لایف نمایش داده شده بود برنده عکس مطبوعات جهان شد، و بعد از اینکه در سال ۱۹۹۲ در یک تبلیغ برای کمپین یونایتد کالر آو بنتون استفاده شد در سراسر جهان بدنام شد.[۲۱۸] در سال ۱۹۹۶ فردی اهل اوگاندا با نام جانسون آزیگا که به کانادا مهاجرت کرده بود، حامل ویروس HIV تشخیص داده شد و علیرغم آگاهی از بیمار بودن خود، با ۱۱ زن نزدیکی داشت بدون آنکه از کاندوم استفاده کند و یا اینکه آنها را از بیماری خود آگاه سازد. این کار وی منجر به مبتلا شدن هفت نفر از آنها به HIV و همچنین کشته شدن دو نفر از آنان بر اثر ایدز شد که این موضوع در سال ۲۰۰۳ فاش شد.[۲۱۹][۲۲۰] پس از برگزاری دادگاههای متوالی، در نهایت آزیگا در سال ۲۰۰۹ به قتل عمد متهم شده و به حبس ابد محکوم شد.[۲۲۱]
انکار و تصورات غلط
عده کمی هنوز درباره ارتباط بین HIV و ایدز[۲۲۲]وجود خود HIV، یا اعتبار آزمایش HIV و روشهای درمان آن اختلاف نظر دارند.[۲۲۳][۲۲۴] جامعه علمی این ادعاها، که به انکارگرایی ایدز معروفند، را مورد بررسی قرار داده و آنها را رد کرده است.[۲۲۵] البته، آنها تاثیرات سیاسی چشمگیری داشتهاند، بخصوص آنکه در آفریقای جنوبی، جایی که دولت با آغوش باز از انکارگرایان ایدز استقبال میکند، آنها مسئول بیمبالاتی دولت در خصوص اپیدمی ایدز در کشور هستند، و مقصر صدها هزار مرگ قابل اجتناب و عفونتهای HIV نیز میباشند.[۲۲۶][۲۲۷][۲۲۸] عملیات اینفکشن عملیات جهانی سنجش فعال اتحاد جماهیر شوروی بود تا همگان را از این امر مطلع کند که ایدز را آمریکا به وجود آورده است. تحقیقات نشان میدهند که تعداد زیادی از مردم این ادعا را باور داشته و هنوز هم دارند.[۲۲۹]
تصورات غلط زیادی درباره HIV و ایدز وجود دارد. سه نوع رایج آنها عبارتند از اینکه ایدز میتواند از راه تماس معمولی منتقل شود، و اینکه نزدیکی جنسی با یک باکره بیماری ایدز را درمان میکند، و نیز HIV تنها میتواند مردان همجنسگرا و مصرف کنندگان مواد مخدر را آلوده کند. سایر تصورات غلط عبارتند از اینکه هر نوع نزدیکی مقعدی بین دو مرد همجنسگرا غیرآلوده میتواند منجر به ابتلا به HIV شود، و بحثهای باز و آزاد درباره همجنسگرایی و HIV در مدارس منجر به افزایش میزان همجنسگرایی و ایدز میشود.[۲۳۰][۲۳۱]
تحقیقات
پژوهشهای انجام شده برای بهبود درمانهای فعلی شامل کاهش عوارض جانبی داروهای کنونی، برنامههای دارویی سادهتر با هدف تعیین برنامههای مناسبتر برای مقاومت در برابر دارو میشود. با این حال، به نظر میرسد که فقط با یک واکسن میتوان این بیماری همهگیر را متوقف کرد. زیرا واکسن هزینه کمتری دارد و برای کشورهای در حال توسعه مقرون به صرفهتر است و به درمان روزانه نیاز ندارد.[۲۳۲] با این حال، پس از بیش از ۲۰ سال تحقیق، واکسن HIV-1 به هدفی دشوار تبدیل شدهاست،[۲۳۲][۲۳۳] و هنوز هیچ درمانی برای آن وجود ندارد.
پیوند سلولهای بنیادی
در سال ۲۰۰۷، به تیموتی ری براون،[۲۳۴] یک فرد ۴۰ ساله مبتلا به HIV، که با نام «بیمار برلین» نیز شناخته میشود، پیوند سلولهای بنیادی به عنوان بخشی از درمانش برای لوسمی میلوئید حاد (AML) داده شد.[۲۳۵]پیوند دوم یک سال پس از عود کردن بیماری انجام شد. اهداکننده نه تنها برای سازگاری ژنتیکی بلکه همچنین برای هموزیگوت بودن برای جهش CCR5-Δ۳۲ انتخاب شد تا مقاومت بیشتری در برابر عفونت HIV صورت گیرد.[۲۳۶][۲۳۷] پس از ۲۰ ماه بدون هیچ گونه درمانی با داروی ضدویروسی، گزارش شد که سطح HIV در خون، مغز استخوان و روده براون زیر حد تشخیص داده شده بود.[۲۳۷] این ویروس تا بیش از سه سال پس از اولین پیوند قابل شناسایی نبود.[۲۳۵] اگر چه محققان و برخی از مفسران، نتیجه را درمان بیان کردهاند، اما دیگران بر این عقیدهاند که این ویروس ممکن است به صورت پنهان در بافتها[۲۳۸] مانند مغز (که به عنوان منبع ذخیره ویروسی عمل میکند) وجود داشته باشد.[۲۳۹] درمان از طریق سلولهای بنیادی به دلیل طبیعت داستانگونهای خود، بیماری و احتمال از بین رفتن پیوند سلولهای بنیادی، و دشواریهای تحقیقاتی پیدا کردن اهداکنندگان مناسب، در حال بررسی است.[۲۳۸][۲۴۰]
عوامل دستگاه ایمنی
در طی تلاشهای انجام شده برای کنترل تکثیر ویروس، ایمن درمانی که میتواند به بهبود دستگاه ایمنی کمک کند، در آزمایشهایی از جمله IL-۲ و IL-۷ بررسی گردیده است.[۲۴۱]
ناتوانی محافظت داوطلبان واکسن در برابر عفونت HIV و پیشرفت ایدز در ساختمان زیستشناختی، به پنهان شدن HIV منجر شده است. شاید روزی با یک دوره محدود درمان ترکیبی ضدویروس و داروی منبع ذخیره نهانی پنهان بتوان عفونت HIV را ریشهکن کرد.[۲۴۲] محققان آبزیمی کشف کردهاند که میتواند پروتئین gp120 متصل به CD4 را از بین ببرد. از آنجا که این پروتئین نقطه اشتراک لنفوسیتهای بی و خطرات احتمالی دستگاه ایمنی بدن است، در همه انواع HIV شایع است.[۲۴۳]
این بیماری توسط سکس و عشق بازی به بدن افراد منتقل میشود.
نظرات شما عزیزان: